
| A. | M一定是第VIA族元素 | B. | M的最高价氧化物为RO2 | ||
| C. | M的气态氢化物一定能形成氢键 | D. | M的气态氢化物溶于水可能显碱性 |
分析 设主族元素M的最高正化合价为x,则最低负价x-8,故有x+(x-8)=2,解得x=+5,该元素处于ⅥA族,负价为-3价,据此解答.
解答 解:设主族元素M的最高正化合价为x,则最低负价x-8,故有x+(x-8)=2,解得x=+5,负价为-3价,
A.氯酸根离子中的氯元素也是+5,所以M不一定是第VIA族元素,故A错误;
B.最高正化合价为+5价,M的最高价氧化物为M2O5,故B错误;
C.M的最低负化合价为-3,氢化物化学式为RH3,如果是氮元素的氢化物能形成氢键,如磷化氢则不能形成氢键,故C错误;
D.若M为N元素,则气态氢化物NH3的水溶液呈碱性,故D正确,
故选D.
点评 本题考查原子结构与元素周期律,关键是清楚元素的最高价和最低负价的关系,难度不大.


科目:高中化学 来源: 题型:选择题
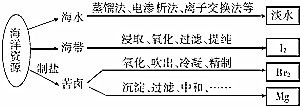
| A. | 从海水中获取淡水,历史最久的方法是离子交换法 | |
| B. | 从海带中获得I2需要用到的主要仪器有蒸发皿、漏斗、烧杯、分液漏斗等 | |
| C. | 用SO2溶液吸收从苦卤中吹出的单质溴时,发生的离子反应是Br2+SO2+2H2O═4H++SO42-+2Br- | |
| D. | 用石灰石、盐酸等从苦卤中提取镁时,发生反应的反应类型有化合、分解、置换和复分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A与D可形成含18e-的离子化合物 | |
| B. | B单质在C单质中燃烧生成原子个数比为1:1的化合物 | |
| C. | D的氧化物为酸性氧化物,溶于水可制得D的含氧酸 | |
| D. | D与E组成的化合物中,各原子最外层均达到8电子结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
| t/min | 0 | 20 | 40 | 60 | 80 |
| C(H2O2)/mol•L-1 | 0.80 | 0.40 | 0.20 | 0.10 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
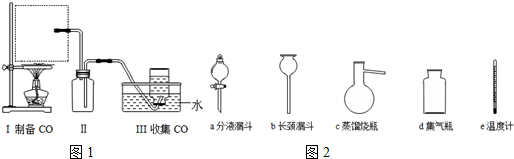
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| N2+3H2?2NH3 | |||
| 起始浓度mol/L | 1.0 | 3.0 | 0 |
| 2秒末浓度mol/L | 0.6 | 1.8 | a |
| A. | 0.2mol/(L•s) | B. | 0.4mol/(L•s) | C. | 0.6mol/(L•s) | D. | 0.8mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
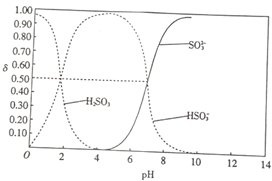 25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )
25℃时,向100mL 1mol•L-1H2SO3溶液中逐渐滴入1mol•L-1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=-lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )| A. | pH=1.85时,c(H2SO3)=c(HSO3-) | |
| B. | pH=6时,c(Na+)>c(HSO3-)>c(SO32-) | |
| C. | pH=7.19时,c(Na+)+c(H+)=c(HSO3-)+2c(SO3-)+c(OH-) | |
| D. | 加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3-)+2c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NaCl的溶解度比I2的溶解度大 | NaCl晶体中C1-与Na+间的作用力大于碘晶体中分子间的作用力 |
| B | 通常条件下,CH4分子比PbH4分子稳定性高 | Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |
| C | 在形成化合物时,同一主族元素的化合价相同 | 同一主族元素原子的最外层电子数相同 |
| D | P4O10、C2H6O溶于水后均不导电 | P4O10、C2H6O均属于共价化合物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
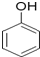 、
、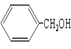 互为同系物
互为同系物| A. | ①②③④ | B. | 只有②③ | C. | 只有③④ | D. | 只有①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com