
下列叙述错误的是( )
A.乙烯和苯都能使溴水褪色,褪色的原因相同
B.淀粉、油脂、蛋白质都能水解,但水解产物不同
C.煤油可由石油分馏获得,可用作燃料和保存少量金属钠
D.乙醇、乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去
科目:高中化学 来源: 题型:
反应A+B===2C,在反应过程中,断裂1mol A中的化学键消耗的能量为Q1 kJ,断裂1mol B中的化学键消耗的能量为Q2 kJ,形成1mol C中的化学键释放的能量为Q3 kJ;1mol A所含化学能为E1 kJ, 1mol B所含化学能E2 kJ,1molC 所含化学能E3 kJ。下列说法中一定正确的是( )
A.若Q1+Q2 < Q3,则反应为放热反应 B.若Q1+Q2 > Q3,则反应为放热反应
C.若E 1+E 2 >E 3,则反应为放热反应 D.若E 1+E 2 >E 3,则反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.汽车尾气中有NOx,主要是汽油不充分燃烧引起的
B.发泡塑料饭盒主要材质是高分子材料,不适于盛放含油较多的食品
C.BaSO4难溶于水,医疗上可用做钡餐
D.为改善食物的色、香、味并防止变质,可在其中加入适量食品添加剂
查看答案和解析>>
科目:高中化学 来源: 题型:
将四个分别盛有足量硫酸铜溶液、氯化铜溶液、氢氧化钾溶液、氯化钠溶液的电解槽串联,用惰性电极电解一段时间后四个电解槽两极共产生气体在同温同压下的体积之比为( )
A.1:1:2:2 B. 1:2:3:4 C. 1:2:2:1 D.2:2:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与硫酸反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ. 铁矿石中含氧量的测定,以下实验过程不完整,请补充完整。
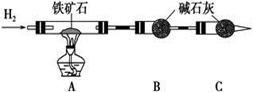
(1) 按上图组装仪器,并检查装置的气密性;
(2) 将8.0 g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
(3) 从左端导气管口处不断地缓缓通入H2,____________________________,再点燃A处酒精灯;
(4) 充分反应后,撤掉酒精灯,再持续通入氢气至硬质玻璃管完全冷却;
(5) 测得反应后装置B增重2.25 g,则铁矿石中氧的百分含量为________。
Ⅱ. 铁矿石中含铁量的测定,流程如下。

(1) 步骤④中煮沸的作用是___________________________________________。
(2) 步骤⑤中用到的玻璃仪器有烧杯、胶头滴管、玻璃棒、________。
(3) 下列有关步骤⑥的操作中说法正确的是________。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.锥形瓶不需要用待测液润洗
c. 滴定前没有气泡,滴定结束后,滴定管尖嘴部分有气泡,则测定结果偏大
d. 滴定过程中,眼睛注视滴定管中液面变化
e. 滴定结束后,30 s内溶液不恢复原来的颜色,再读数
(4) 滴定过程中消耗了0.500 0 mol·L-1 KI溶液20.00 mL。
Ⅲ. 由Ⅰ、Ⅱ可以推算出该铁矿石中如只有一种铁的氧化物,则其化学式为_____ ___。
查看答案和解析>>
科目:高中化学 来源: 题型:
2005年诺贝尔化学奖获得者施罗克等人发现金属钼的卡宾化合物可以作为非常有效的烯烃复分解催化剂。工业上冶炼钼的化学原理为:( )
①2MoS2+7O2=(高温)2MoO3+4SO2; ②MoO3+2NH3·H2O=(NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl; ④H2MoO4=(△)MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.MoS2煅烧产生的尾气可直接排入空气中
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和铝分别还原等量的MoO3,消耗还原剂的物质的量比为3:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能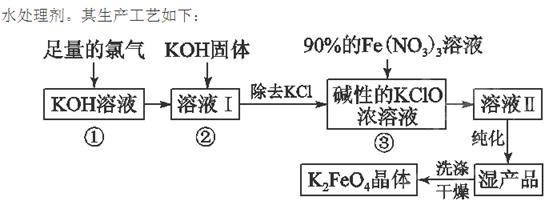 (1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,该反应的氧化产物是 。
(2)在溶液Ⅰ中加入KOH固体的目的是 (填编号)。
A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为KClO
(3)从溶液Ⅱ中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,配平该反应的离子方程式:
___FeO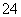 +____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
+____H2O — ____Fe(OH)3(胶体)+____O2↑+____OH-。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是一些早期文献中的论述,根据你目前所掌握的知识,其中说法不确切的是
①玻义耳:能使石蕊试液变红的物质都是酸,能使石蕊试液变蓝的物质都是碱
②拉瓦锡:一切非金属氧化物对应的水化物都是酸,金属氧化物对应的水化物都是碱
③门捷列夫:元素的性质随相对原子质量增大而呈周期性变化
④塑料一定不能导电,是良好的电绝缘体
A.①②③④ B.①②③ C.③④ D.①②
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com