
【题目】以下物质间的每步转化通过一步反应就能实现的是( )
A.Al﹣Al2O3﹣Al(OH)3﹣NaAlO2
B.S﹣SO3﹣H2SO4﹣MgSO4
C.Mg﹣MgCl2﹣Mg(OH)2﹣MgO
D.Si﹣SiO2﹣H2SiO3﹣Na2 SiO3
科目:高中化学 来源: 题型:
【题目】已知酸性:![]() >H2CO3>
>H2CO3>![]() , 将
, 将 转变为
转变为![]() 的方法是( )
的方法是( )
A.与足量的NaOH溶液共热,再通入足量的CO2
B.与稀H2SO4共热后,加入足量的NaOH溶液
C.加热溶液,通入足量的CO2
D.与稀H2SO4共热后,加入足量的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4 . 考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图),使浆液分离成固体混合物和含铬元素溶液,并回收利用.回答Ⅰ和Ⅱ中的问题.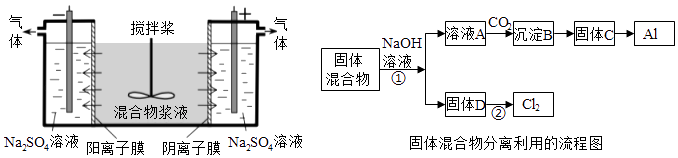
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为 . B→C的反应条件为 , C→Al的制备方法称为 .
(2)该小组探究反应②发生的条件.D与浓盐酸混合,不加热,无变化;加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2 . 由此判断影响该反应有效进行的因素有(填序号) .
a.温度 b.Cl﹣的浓度 c.溶液的酸度
(3)0.1mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2xH2O的液态化合物,放热4.28kJ,该反应的热化学方程式为 .
Ⅱ含铬元素溶液的分离和利用
(4)用惰性电极电解时,CrO42﹣能从浆液中分离出来的原因是 , 分离后含铬元素的粒子是;阴极室生成的物质为(写化学式).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1﹣18号的短周期主族元素中,表中的字母代表一种元素,回答下列问题: 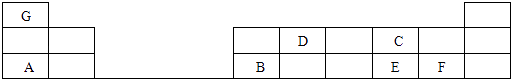
(1)D的元素名称为;
(2)G和F形成化合物的电子式为;
(3)C和E分别形成的气态氢化物中最稳定的是(填写氢化物的化学式)
(4)A最高价氧化物的水化物和B的最高价氧化物的水化物反应的化学方程为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2Sx(2≤x≤8).下列说法错误的是( )
A.电池工作时,正极可发生反应:2Li2S6+2Li++2e﹣=3Li2S4
B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 g
C.石墨烯的作用主要是提高电极a的导电性
D.电池充电时间越长,电池中的Li2S2量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3 , 还含有硅、铝等杂质.制备流程如图所示: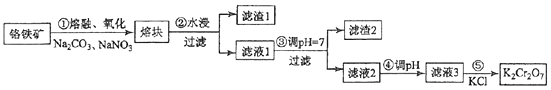
回答下列问题:
(1)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
(2)滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质.
(3)步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示).
(4)有关物质的溶解度如图所示.
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 .
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景.回答下列问题:
(1)Co基态原子核外电子排布式为 . 元素Mn与O中,第一电离能较大的是 , 基态原子核外未成对电子数较多的是 .
(2)CO2和CH3OH分子中C原子的杂化形式分别为和 .
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为 , 原因是 .
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在 .
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2﹣)为nm.MnO也属于NaCl型结构,晶胞参数为a'=0.448nm,则r(Mn2+)为nm.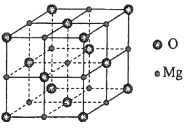
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有10mL1molL﹣1 NH4Al(SO4)2溶液的烧杯中滴加1molL﹣1NaOH溶液,沉淀物质的量随NaOH溶液体积变化示意图如下: 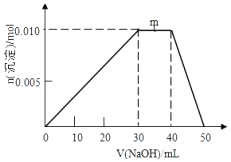
①写出m点反应的离子方程式: .
②若10mL1molL﹣1 NH4Al(SO4)2溶液中改加20mL1.2molL﹣1Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为mol(列式计算)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com