
 25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )
25℃时,向100mL 0.1mol•L-1 NH4HSO4溶液中滴加0.1mol•L-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸).下列说法错误的是( )| A. | a点时溶液的pH<1 | |
| B. | c点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+) | |
| C. | de段上的点均满足关系式:c(NH4+)+c(Na+)>2c(SO42-) | |
| D. | a点到b点的过程中,溶液的导电能力增强 |
分析 a、b、c、d、e五个点,根据反应量的关系,b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4;c、d、e三点溶液均含有NH3•H2O,(NH4)2SO4可以促进水的电离,而NH3•H2O抑制水的电离.c点溶液呈中性,则溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,
A.0.1mol•L-1 NH4HSO4溶液中铵根离子水解溶液氢离子浓度大于0.1mol/L;
B.c点溶液呈中性,则溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分;
C.de段上的点氢氧化钠过量,溶液显碱性,结合溶液中电荷守恒分析判断;
D.b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,离子浓度减小;
解答 解:A.0.1mol•L-1 NH4HSO4溶液中铵根离子水解溶液氢离子浓度大于0.1mol/L,a点时溶液的pH<1,故A正确;
B.c点溶液呈中性,即溶液含有(NH4)2SO4、Na2SO4、NH3•H2O三种成分,b点时c(Na+)=c(SO42-),b点时c(Na+)>c(SO42-),根据N元素与S元素的关系,可以得出c(SO42-)>c(NH4+),故c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故B正确;
C.de段上的点氢氧化钠过量,溶液显碱性,溶液中电荷守恒为:c(NH4+)+c(Na+)+c(H+)=2c(SO42-)+c(OH-),c(OH-)>c(H+),c(NH4+)+c(Na+)>2c(SO42-),故C正确;
D.b点恰好消耗完H+,溶液中只有(NH4)2SO4与Na2SO4,溶液中溶质都是强电解质,溶液中离子浓度减小,导电性变化减小,故D错误;
故选D.
点评 本题考查了电解质溶液中离子浓度大小、电荷守恒分析,主要是图象变化和反应后溶液PH变化,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 属于烃类 | B. | 由不同酯组成的混合物 | ||
| C. | 密度比水大 | D. | 不能发生皂化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为除去FeCl2溶液中少量的FeCl3,可加入过量铁粉,再过滤 | |
| B. | 明矾中Al3+水解产生具有吸附性的胶体,明矾可用于自来水的净化 | |
| C. | 为除去CO2中少量的HCl,可使其通过饱和的Na2CO3溶液 | |
| D. | 为除去KCl溶液中少量的MgCl2,可加入适量KOH溶液,再过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L的NaClO溶液中含ClO-的浓度小于0.1mol/L | |
| B. | 标准状况下,22.4L乙烯中含极性共价键数为4NA | |
| C. | 1 mol氢氧根离子与1mol羟基所含电子数均为10NA | |
| D. | 3.0g甲醛和甲酸甲酯的混合物中含有的原子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,负极质量增加 | |
| B. | 放电时,溶液中的BF4-只向正极移动 | |
| C. | 充电时,阳极附近溶液的酸性增强 | |
| D. | 充电时,阴极的电极反应式为Pb2+-2e-=Pb |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应物 | 反应条件1 | 反应条件2 | |
| A | CH3CHICH3 | NaOH的水溶液,加热 | NaOH的乙醇溶液,加热 |
| B | 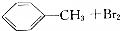 | 光照 | 铁粉 |
| C | 乙醇+氧 | 点燃 | Cu做催化剂,加热 |
| D | 乙烯 | 溴水 | 溴的四氯化碳溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、SO42-、Cl2 | B. | Ca2+、Na+、Br-、CO32- | ||
| C. | Na+、Fe2+、Cl-、NO3- | D. | K+、Ag+、NH3•H2O、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 低温、高压、催化剂 | B. | 高温、高压 | ||
| C. | 尽可能的高温、高压 | D. | 适宜的温度、高压、催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com