
【题目】某化学学习小组欲探究己烷的性质,用己烷进行下列实验:
实验1:

实验2:将上述橙色溶液装入密封性好的无色试剂瓶中。过一段时间,溶液颜色变浅,打开瓶盖瓶口出现白雾。
实验3:利用如图所示实验装置在一定条件分解己烷(生成丙烷和丙烯![]() ),且丙烯能被酸性
),且丙烯能被酸性![]() 溶液氧化。
溶液氧化。
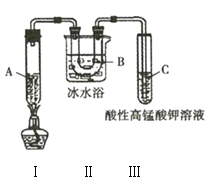
(1)实验1中用到的玻璃仪器主要有______________________________________(填名称)。
(2)由实验1可知,己烷的物理性质有____________________________________。
(3)实验2中的橙色溶液逐渐变浅的原因是__________________(填序号)。
A.己烷与溴发生了取代反应
B.溴代己烷为无色物质
C.液溴向外挥发浓度降低
D.己烷与液溴发生了加成反应
E.液溴与己烷分层,密度大的液溴在下层
(4)实验3中装置Ⅱ的作用是______________________________________。
(5)试管C中的现象是______________________________________。
(6)试写出装置Ⅰ中发生的生成丙烷和丙烯的化学方程式:______________________________________。
【答案】烧杯、分液漏斗(有无玻璃棒均正确) 己烷的密度比水小,难溶于水,可溶解溴 AB 冷凝己烷分解产生的气体 酸性高锰酸钾溶液的紫色褪去 ![]()
【解析】
(1)实验①的主要操作是分液,需要的玻璃仪器主要是烧杯和分液漏斗,故答案为:烧杯、分液漏斗;
(2)溴水和己烷混合后,下层几乎是无色的,且分液后得到橙色溶液,这说明己烷比水轻,难溶于水,可溶解溴,故答案为:己烷比水轻,难熔于水,可溶解溴;
(3)由于打开瓶盖瓶口出现白雾,这说明有溴化氢生成。由于己烷是烷烃,能和溴发生取代反应生成溴代烷和溴化氢,因此正确的答案选AB,故答案为:AB;
(4)实验3的装置Ⅱ中有冰水浴,所以该装置的作用是冷凝己烷分解产生的气体,故答案为:冷凝己烷分解产生的气体;
(5)己烷裂化有气态的烯烃生成,烯烃含有碳碳双键,能被酸性高锰酸钾溶液氧化,因此看到试管C中酸性高锰酸钾的紫色褪去,故答案为:酸性高锰酸钾的紫色褪去;
(6)在一定条件下,己烷裂化生成丙烷和丙烯,反应的化学方程式是CH3(CH2)4CH3 ![]() CH3CH2CH3﹢CH3CH=CH2,故答案为:CH3(CH2)4CH3
CH3CH2CH3﹢CH3CH=CH2,故答案为:CH3(CH2)4CH3 ![]() CH3CH2CH3﹢CH3CH=CH2。
CH3CH2CH3﹢CH3CH=CH2。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图),下列对于试管内发生的反应及现象的说法正确的是( )
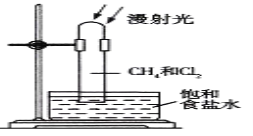
A. 反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生
B. 将该装置放在黑暗处,![]() 与
与![]() 也能反应
也能反应
C. 该反应仅得到一种有机产物
D. ![]() 和
和![]() 完全反应后液面上升,液体充满试管
完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.有机物的表示方法多种多样,下面是常用的有机物的表示方法:
①![]() ②CH3CH2CH(CH3)CH3③CH4 ④
②CH3CH2CH(CH3)CH3③CH4 ④ ⑤
⑤
⑥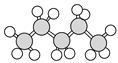 ⑦
⑦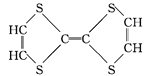 ⑧
⑧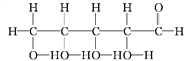
(1)上述表示方法中属于结构简式的是_______________(填序号,下同),属于比例模型的是_______。
(2)写出⑧中官能团的名称:____________、____________。
(3)____________和____________互为同分异构体。
Ⅱ.(1)写出下列有机物的结构简式:
①2,4二甲基3乙基己烷____________;
②2甲基2戊烯____________。
(2)对下列有机物进行命名:
①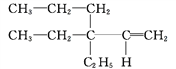 ____________。
____________。
②(CH3)3CCH(CH3)CH2CH3____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是( )
A.烷烃中除甲烷外,很多都能使酸性![]() 溶液的紫色退去
溶液的紫色退去
B.甲烷跟氯气反应无论生成![]() 、
、![]() 、
、![]() 还是
还是![]() ,都属于取代反应
,都属于取代反应
C.分子式符合![]() 的烃一定是烷烃
的烃一定是烷烃
D.甲烷能够燃烧,在一定条件下会发生爆炸,因此甲烷是矿井安全的重要威胁之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C2H2)是基本有机化工原料。由A制备聚乙烯醇缩丁醛和顺式聚异戊二烯的合成路线(部分反应条件略去)如下所示:
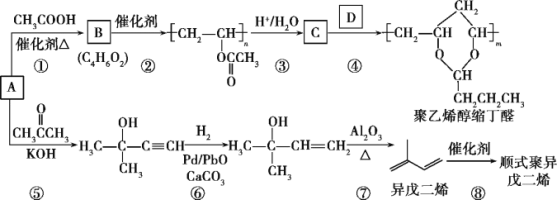
回答下列问题:
(1)A的名称是___________,C含有的官能团是___________。
(2)⑤的反应类型是___________,⑦的反应类型是___________。
(3)B和D的结构简式分别为___________、___________。
(4)异戊二烯分子中最多有___________个原子共平面,顺式聚异戊二烯的结构简式为___________。
(5)参照异戊二烯的上述合成路线,设计一条由A和乙醛为起始原料制备1,3-丁二烯的合成路线___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用下列装置制备漂白粉,下列说法不正确的是( )
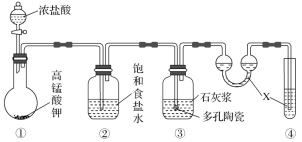
A.装置④中的X试剂为NaOH溶液
B.装置②中饱和食盐水的作用是除去Cl2中的HCl
C.装置③中的石灰浆可以用石灰水代替
D.制备漂白粉的反应是放热反应,温度较高时有副反应发生,可以将装置③放在冷水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,最终的白色沉淀物不一定是BaSO4的是( )
A.Fe(NO3)2溶液![]() 白色沉淀
白色沉淀
B.Ba(NO3)2溶液![]() 白色沉淀
白色沉淀
C.无色溶液![]() 白色沉淀
白色沉淀
D.无色溶液![]() 无色溶液
无色溶液![]() 白色沉淀
白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下实验设计能达到实验目的的是( )
选项 | 实验目的 | 实验设计 |
A | 证明非金属性强弱:Cl>C>Si |
|
B | 鉴别NaBr和KI溶液 | 分别加新制氯水后,用CCl4萃取 |
C | 除去NaHCO3固体中的Na2CO3 | 将固体加热至恒重 |
D | 证明相同温度下: Ksp(Ag2S)<Ksp(AgCl) | 向2 mL 0.1 mol·L-1硝酸银溶液中加入1 mL 0.1 mol·L-1 NaCl溶液,出现白色沉淀,再加入 几滴0.1 mol·L-1 Na2S溶液,有黑色沉淀生成 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理汽车尾气和燃煤尾气是环境保护的重要课题.请回答下列问题:
(1)在汽车排气系统中安装三元催化转化器,可发生反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
2CO2(g)+N2(g).在恒容密闭容器中通入等量的CO和NO,发生上述反应时,c(CO)随温度(T)和时间(t)的变化曲线如图所示.
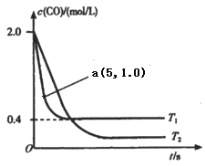
①据此判断该反应的正反应为____(填“放热”或“吸热”)反应.
②温度T1时,该反应的平衡常数K=_____;反应速率v=v(正)-v(逆)=k正c2(NO)c2(CO)- k逆c2(CO2)c(N2),k正、k逆分别为正、逆反应速率常数,计算a处v(正):v(逆)=________.
(2)下图流程是一种新型的除去尾气中氮氧化物的技术,一般采用氨气或尿素作还原剂
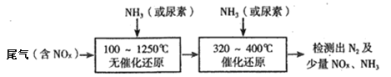
该技术中用尿素[CO(NH2)2]作还原剂还原NO2的主要反应为:4CO(NH2)2+6NO2![]() 4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
4CO2+7N2+8H2O ,则用NH3作还原剂还原尾气中NO(NH3、NO的物质的量之比为1:1)的化学方程式为:______.
(3)哈伯法合成氨的流程图如图,下列五个流程中为提高原料利用率而采取的措施________(填序号)
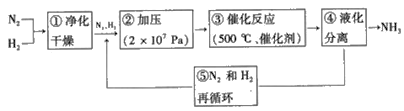
(4)一种电化学制备NH3的装置如图所示,图中陶瓷在高温时可以传输H+.下列叙述正确的是______________(填选项)
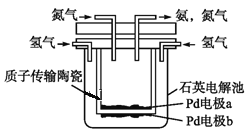
A.Pd电极b为阴极 B.阴极的反应式为N2+6H++6e-=2NH3
C.H+由阳极向阴极迁移 D.陶瓷可以隔离N2和H2
(5)也可用CH4催化还原NOx法消除烟气中氮氧化物的污染.已知:
①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H=-867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H=+67.0 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0 kJ/mol
则CH4催化还原NO的热化学方程式为__________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com