
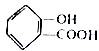
 与
与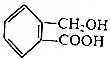 互为同系物
互为同系物 ,请写出将
,请写出将 转化为
转化为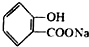 的化学方程式
的化学方程式 +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑. 分析 (1)水杨酸含酚-OH、-COOH,结合酚、羧酸的性质分析;
(2)酚-OH、-COOH均反应生成 ,将
,将 转化为
转化为 ,只有-COOH反应.
,只有-COOH反应.
解答 解:(1) 与
与 分别为酚、醇羟基,结构不同,不互为同系物,故A错误;
分别为酚、醇羟基,结构不同,不互为同系物,故A错误;
B.苯环、羰基为平面结构,水杨酸分子中所有原子可能都在同一平面上,而-COOH上H不一定在同一平面上,故B错误;
C.水杨酸含酚-OH、-COOH,既可以看成是酚类物质,也可以看成是羧酸类物质,故C正确;
故答案为:C;
(2)酚-OH、-COOH均反应生成 ,则将水杨酸与Na或NaOH或碳酸钠溶液作用,可以生成
,则将水杨酸与Na或NaOH或碳酸钠溶液作用,可以生成 ;
;
将 转化为
转化为 ,只有-COOH反应,反应为
,只有-COOH反应,反应为 +NaHCO3→
+NaHCO3→ +H2O+CO2↑,
+H2O+CO2↑,
故答案为:Na或NaOH或碳酸钠; +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、羧酸的性质及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 此法的优点之一是原料丰富 | |
| B. | 进行①②③步骤的目的是从海水中提取MgCl2 | |
| C. | 第④步电解时同时会产生氯气 | |
| D. | 以上提取镁的过程中涉及到的反应有分解反应、化合反应和置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在反应中不一定所有元素的化合价都发生变化 | |
| B. | 化合反应和分解反应不可能是氧化还原反应 | |
| C. | 氧化还原反应中不一定要有氧气参与反应 | |
| D. | 工业上利用CO与Fe2O3作用炼铁的反应是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
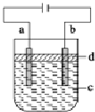
| A. | a电极的材料应为铁 | |
| B. | d为苯,其作用为防止空气中的O2把Fe(OH)2氧化 | |
| C. | 电解液c可以是NaCl溶液、NaOH溶液等 | |
| D. | 若电解过程中阳极消耗铁11.2g,理论上阴极产生气体为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
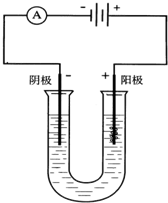 如图以石墨作电极,电解下列溶液,写出电极反应及电解总反应式.
如图以石墨作电极,电解下列溶液,写出电极反应及电解总反应式.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com