
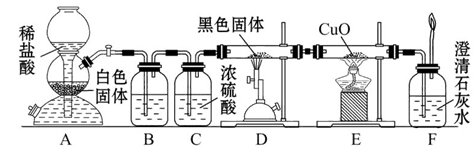
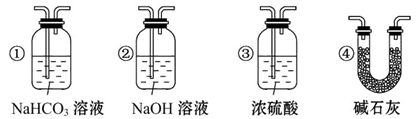
 2CO
2CO 2CO。
2CO。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案科目:高中化学 来源:不详 题型:填空题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能(KJ/mol) | 356 | 413 | 336 | 226 | 318 | 452 |
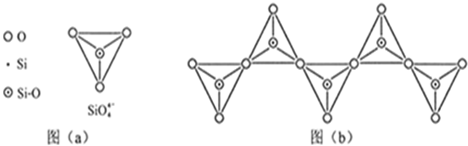
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③④⑤⑦ | B.①②⑦⑧ | C.⑥⑧ | D.全部 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)
Si3N4(s)+12HCl(g) ΔH=a kJ/mol(a<0)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CO2、CH4、N2等均是造成温室效应的气体 |
| B. 14C可用于文物鉴定,14C与12C互为同素异形体 |
| C.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
D.精炼粗铝时要清除坩埚表面的石英砂,铝与石英砂反应的方程式为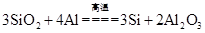 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①、②和④ | B.只有② | C.②和③ | D.②和④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 CH3OH(g)△H1=-116 kJ·mol-1
CH3OH(g)△H1=-116 kJ·mol-1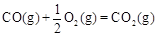 △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1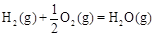 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
 CH3OH(g)的平衡常数K= 。
CH3OH(g)的平衡常数K= 。 | | 0min | 5min | 10min |
| CO | 0.1 | | 0.05 |
| H2 | 0.2 | | 0.2 |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com