
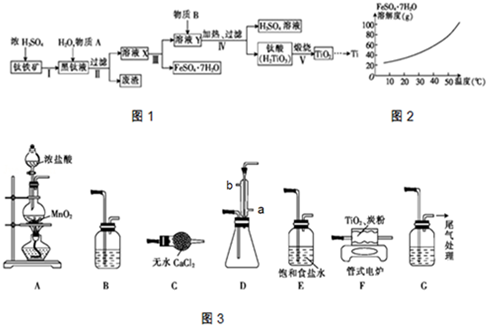
分析 钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,所以物质A为Fe,溶液X中含有FeSO4和TiOSO4,经过分离得硫酸亚铁晶体和溶液Y,溶液Y主要含有TiOSO4,加入水,加热可水解生成H2TiO3,所以物质B为H2O,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti,以此解答该题.
解答 解:钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,可防止Fe2+氧化,所以物质A为Fe,溶液X中含有FeSO4和TiOSO4,经过分离得硫酸亚铁晶体和溶液Y,溶液Y主要含有TiOSO4,加入水,加热可水解生成H2TiO3,所以物质B为H2O,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti,
(1)根据上面的分析可知,A为Fe,B为H2O,
故答案为:Fe;H2O;
(2)根据FeSO4•7H2O的溶解度曲线可知,硫酸亚铁的溶解度随温度的升高而增大,所以从溶液中分离出FeSO4•7H2O,可以通过降温、结晶、过滤的方法获得,
故答案为:降温、结晶、过滤;
(3)根据由TiO2制备金属Ti的原理可知,先用浓盐酸与二氧化锰制得氯气,制得的氯气中有氯化氢、水等杂质,可以通过饱和食盐水和浓硫酸除去,再在管式电炉中生成四氯化钛,反应中有未反应的氯气,会污染空气,所以尾气要用氢氧化钠溶液吸收,为防止尾气吸收装置中的水分挥发到收集四氯化钛的容器中,在收集装置和尾气处理装置之间要加一个干燥装置,所以①装置按气流方向连接起来的顺序为A、E、B、F、D、C、G,②根据上面的分析可知,B中装浓H2SO4,G中装NaOH溶液,③装置D中冷凝管的作用为冷凝产品得TiCl4液体,冷凝进采用逆流的冷凝效果比较好,所以冷凝管中水流方向为a进b 出,
故答案为:①E、B、F、D、G;②浓H2SO4;NaOH溶液;③冷凝产品得TiCl4液体,a进b 出;
(4)根据电子得失守恒可知,将TiO2溶解并还原为Ti3+,Ti3+与NH4Fe(SO4)2溶液反应时有关系式TiO2~Ti3+~NH4Fe(SO4)2,消耗0.20mol•L-1的NH4Fe(SO4)2溶液36.75mL,即NH4Fe(SO4)2的物质的量为36.75×10-3L×0.20mol•L-1=7.35×10-3mol,则TiO2的物质的量为=7.35×10-3mol,所以样品中TiO2的质量分数是$\frac{7.35×10{\;}^{-3}×80}{0.60}$×100%=98%,
故答案为:98%.
点评 本题考查物质的制备实验方案的设计,侧重于学生的分析能力和实验能力及计算能力的考查,为高考常见题型,难度中等,注意把握实验的基本原理和物质的性质.


科目:高中化学 来源: 题型:选择题
| A. | 所得的分散系属于悬浊液 | |
| B. | 该分散系能产生丁达尔效应 | |
| C. | 所得的分散系中水是分散质 | |
| D. | 将所得分散系过滤,在滤纸上能得到分散质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间 (s)浓度 mol•L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
| C(N2O4) | 0.20 | C1 | 0.10 | C3 | C4 | C5 |
| C(NO2) | 0.00 | 0.12 | C2 | 0.22 | 0.22 | 0.22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应过程中,一定有化学键的断裂和形成 | |
| B. | 日常生活中的废旧电池会污染环境,所以应集中填埋处理 | |
| C. | 化学反应过程中,分子的种类和数目一定发生改变 | |
| D. | 放热反应的反应速率,一定比吸热反应的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:
原子序数依次增大的四种主族元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D原子外围电子排布为3d104s1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙试液显红色的溶液 Fe3+、NH4+、Cl-、SCN- | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+ | |
| C. | pH值为1的溶液 Cu2+、Na+、Mg2+、NO3- | |
| D. | 所含溶质为Na2SO4的溶液 K+、HCO3-、NO3-、H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com