
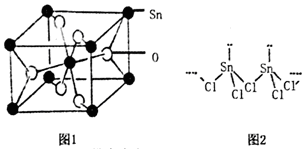
分析 (1)Sn属于ⅣA族元素,价电子排布式为ns2np2,位于第5周期,可确定其价电子排布式;
(2)根据图2中原子成键规则判断出O和Sn所在晶胞位置,利用均摊法计算;
(3)根据白锡和灰锡的配位数和空间利用率判断密度;
(4)计算SnCl4分子价电子对数;判断两种化合物晶体类型;
(5)配位键为Sn提供空轨道,Cl提供孤对电子,根据图1可知形成两条共价键的Cl,其中一条为配位键;SnCl2的一维链状聚合结构中,Sn形成了四条键,杂化类型为sp3,气体分子为单分子,即形成两条共价键的Cl断开其中一条,则Sn形成三条键,杂化类型为sp2;
(6)利用ρ=$\frac{m}{V}$进行计算;根据边长计算原子半径.
解答 解:(1)Sn属于ⅣA族元素,价电子排布式为ns2np2,位于第5周期,可确定其价电子排布式为:5s25p2,
故答案为:5s25p2;
(2)晶胞中O可形成两条共价键,则图2中红球代表O原子,白球代表Sn,所以O位于体心和面心,数目为4×$\frac{1}{2}$=4,Sn位于顶点和体心,数目为8×$\frac{1}{8}$+1=2,原子数目比为2:1,写出化学式为SnO2,
故答案为:SnO2;
(3)白锡的晶体结构中Sn原子的配位数为4和6,灰锡的晶体结构与金刚石的晶体结构相似,配位数为4,前者配位数较大,其空间利用率较大,所以其密度大于灰锡,故答案为:配位数大,空间利用率大;
(4)SnCl4分子价电子对数为$\frac{4+4}{2}$=4,形成了四条杂化轨道,杂化轨道空间构型为正四面体,且每条杂化轨道均与Cl形成共价键,其空间构型为正四面体;SnCl4蒸气遇氨及水汽呈浓烟状,因而可制作烟幕弹,则生成了NH4Cl,所以反应的方程式为:SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;故答案为:正四面体;SnCl4+4NH3+4H2O=Sn(OH)4+4NH4Cl;
(5)配位键为Sn提供空轨道,Cl提供孤对电子,根据图1可知形成两条共价键的Cl,其中一条为配位键,配位键表示为由形成两条共价键的Cl指向Sn,所以在分子结构中存在的化学键是共价键、配位键;SnCl2的一维链状聚合结构中,Sn形成了四条键,杂化类型为sp3,气体分子为单分子,即形成两条共价键的Cl断开其中一条,则Sn形成三条键面,杂化类型为sp2;
故答案为:共价键、配位键;sp3、sp2;
(6)灰锡晶胞中含有8个Sn原子,晶胞的摩尔质量为:119×8=952g/mol,晶胞的体积为(a×10-10)3,摩尔体积为NA(a×10-10)3,所以密度为$\frac{952}{NA(a×1{0}^{-10})^{3}}$=$\frac{952}{6.02×1{0}^{23}×(648.9×1{0}^{-10})^{3}}$,设半径为r;原子紧密相邻,则r=$\frac{1}{2}×$$\frac{\sqrt{3}}{4}a$═$\frac{1}{2}×$$\frac{\sqrt{3}}{4}$×648.9pm=140.5pm,
故答案为:$\frac{952}{6.02×1{0}^{23}×(648.9×1{0}^{-10})^{3}}$;140.5pm.
点评 本题考查较为全面,涉及到价电子排布式、分子空间构型、杂化类型的判断以及有关晶体的计算,但解题具有较强的方法性和规律性,学习中注意总结如何书写电子排布式,如何判断分子空间构型以及有关晶体计算等方法.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化性:F2>Cl2 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 金属单质置换出氢的能力:K>Na | D. | 酸性:H2SO4>HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在普通钢中加入镍、铬等多种元素可炼成不锈钢 | |
| B. | 硬铝、青铜、金箔都属于合金,合金的性能一般优于纯金属 | |
| C. | 镁在空气中燃烧发出耀眼的白光,可用于制作照明弹 | |
| D. | 日用铝制品表面覆盖着致密的氧化膜,对内部金属起保护作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 ,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);
,要进一步提纯,下列操作中必须的是C(填入正确选项前的字母);查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙二醇和丙三醇 | B. | C6H5OH和C6H5CH2OH | ||
| C. | C3H6和C4H8 | D. | C3H8和C4H10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色植物的光合作用是把热能转化为化学能的过程 | |
| B. | 生物质能是与化学反应无关的一种能源 | |
| C. | 物质燃烧一定是放热反应 | |
| D. | 化学能只能以热能的形式释放 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com