
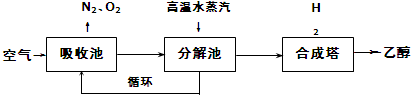
 | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
分析 (1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3;
(2)由工艺流程转化关系可知,分解池中KHO3分解生成K2CO3,碳酸钾在被循环利用;
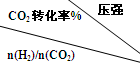
(3)由表中数据可知,温度一定时,n(H2)/n(CO2)越大,CO2转化率越高,有利于CH3CH2OH生成.
解答 解:(1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3,反应离子方程式为CO2+CO32-+H2O=2HCO3-,
故答案为:CO2+CO32-+H2O=2HCO3-;
(2)由工艺流程转化关系可知,分解池中KHO3分解生成K2CO3,碳酸钾在被循环利用吸收空气中二氧化碳,
故答案为:K2CO3;
(3)由表中数据可知,温度一定时,n(H2)/n(CO2)越大,CO2转化率越高,有利于CH3CH2OH生成,
故答案为:有利.
点评 本题考查了乙醇工业制法,题目难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.


科目:高中化学 来源: 题型:解答题
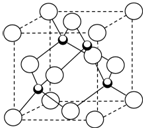 原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
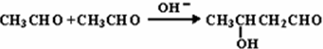
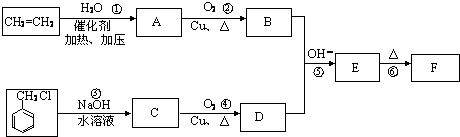
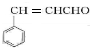 .E中含氧官能团的名称为醛基、羟基.
.E中含氧官能团的名称为醛基、羟基.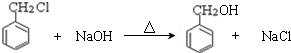
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
| 实验序号 | 反应温度/℃ | H2C2O4溶液 | 酸性KMO4溶液 | H2O | ||
| V/mL | c/(mol•L-1) | V/mL | c/(mol•L-1) | V/mL | ||
| ① | 25 | 8.0 | 0.20 | 5.0 | 0.010 | 0 |
| ② | 25 | 6.0 | 0.20 | 5.0 | 0.010 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
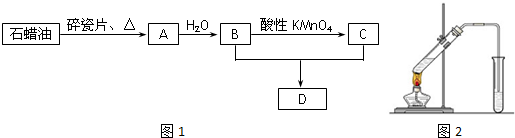
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉检验方法:加碘化钾变蓝 | B. | 蛋白质检验方法:浓硝酸或燃烧法 | ||
| C. | 蛋白质最终水解产物:葡萄糖 | D. | 淀粉最终水解产物:二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu+S$\frac{\underline{\;\;△\;\;}}{\;}$CuS | B. | 3Cu+8HNO3(浓)═3Cu(N03)2+2N0↑+4H20 | ||
| C. |  +HO-NO2$\stackrel{浓硫酸}{→}$ +HO-NO2$\stackrel{浓硫酸}{→}$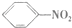 +H2O +H2O | D. | 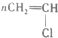 $\stackrel{引发剂}{→}$ $\stackrel{引发剂}{→}$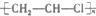 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
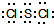 ,它在常温下呈液态,形成晶体时,属于
,它在常温下呈液态,形成晶体时,属于查看答案和解析>>
科目:高中化学 来源: 题型:解答题
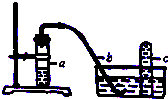 实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.
实验室用如图装置,利用Cu与HNO3反应来制取NO并用排水法收集气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com