
【题目】化学与人类生产、生活密切相关,下列说法错误的是()
A.采用催化抟化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毐气体
B.“雾霾天气” “温室效应” “光化学烟雾”的形成都与氮的氧化物无关
C.利用风能.太阳能等淸洁能源代替化石燃料,可减少环境污染
D.氮化硅陶瓷是一种新型无机非金属材料
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( )
A.Ca2+、Na+、NO3﹣、Fe2+
B.Ca2+、Na+、Fe3+、NO3﹣
C.K+、Cl﹣、HCO3﹣、NO3﹣
D.Mg2+、Cl﹣、NH4+、SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

图Ⅰ 图Ⅱ 图Ⅲ 图Ⅳ
A.图Ⅰ表示H2与O2发生反应过程中的能量变化,则H2的燃烧热△H =-241.8 kJ·mol-1
B.图Ⅱ表示反应A2 (g)+ 3B2 (g)![]() 2AB3(g),达到平衡时A2的转化率大小为:b>a>c
2AB3(g),达到平衡时A2的转化率大小为:b>a>c
C.图Ⅲ表示0.1mol MgCl2·6H2O在空气中充分加热时固体质量随时间的变化
D.图Ⅳ表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH大于同浓度NaB溶液的pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质电离的叙述中,正确的是
A. 碳酸钙在水中溶解度很小,其溶液的电阻率很大,所以碳酸钙是弱电解质
B. 碳酸钙在水中的溶解度很小,但被溶解的碳酸钙全部电离,所以碳酸钙是强电解质
C. 氯气和氨气的水溶液导电性都很好,所以它们是强电解质
D. 水难电离,纯水几乎不导电,所以水是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
(1) 实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率等于____________。
(2) 实验②中,该反应的平衡常数K=____________。
(3) 实验③中,达到平衡时,X的转化率为____________。
(4) 实验④中,达到平衡时,b____________0.060 (填大于、小于、等于)
(5) 实验③中,达到平衡时,a等于 ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作后溶液的颜色无明显变化的是
A. 硫酸铁溶液中滴加硫氰化钾溶液 B. 氯化铝中滴加石蕊指示剂
C. 偏铝酸钠溶液中滴加酚酞指示剂 D. 氯化亚铁溶液中滴加硫氰化钾溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,当关闭K时,向A 中充入2molX、7molY,向B中充入4molX、14molY,起始时体积V(A)=V(B)=a L,在相同温度和有催化剂存在的条件下,两容器各自发生下列反应:2X(g)+2Y(g)![]() Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
Z(g)+2W(g)△H<0达到平衡(Ⅰ)时V(B)=0.9a L,试回答:
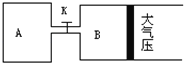
(1)B中X的转化率α(X)B为_________。
(2)A中W和B中Z的物质的量的比较:n(W)A __________________ n(Z)B(填<、>、或=)
(3)打开K,过一段时间重新达平衡(Ⅱ)时,B的体积为_________升(用含a的代数式表示,连通管中气体体积不计)
(4)要使B容器恢复原来反应前的体积,可采取的措施是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
A .新平衡体系中,SO2和O2物质的量之比仍为2∶1
B .平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C .新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D .若采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com