
【题目】某二元酸在水中的电离方程式为:H2B=H++HB-; HB-![]() H++B2-。回答下列问题:
H++B2-。回答下列问题:
(1)Na2B 溶液显__________(填“酸性、中性、或碱性”),理由是(用离子方程式表示):____________________________________________。
(2)在0.1mol/L 的Na2B 溶液中,下列粒子浓度关系正确的是__________。
A.c(B2-)+c(HB–)+c(H2B)=0.1 mol/L
B.c(Na+)+ c(H+)= c(HB–)+c(OH–) +2c(B2-)
C.c(Na+)=2c(HB–) +2c(B2-)
D. c(H+)=c(OH–)-c(HB–)-2c(H2B)
(3)已知0.1 mol/LNaHB溶液的pH=2,则0.1 mol/LH2B溶液中c(H+)可能是_____0.11mol/L(填“<”、“>”或“=”),理由是_______________________。
(4)0.1mol/LNaHB溶液中各种离子浓度大小为_________________________。
【答案】 碱性 B2-+H2O![]() HB-+OH- BC < H2B第一步电离产生的H+,抑制了HB-的电离 c(Na+)>c(HB–) >c(H+)>c(B2–)>c(OH–)
HB-+OH- BC < H2B第一步电离产生的H+,抑制了HB-的电离 c(Na+)>c(HB–) >c(H+)>c(B2–)>c(OH–)
【解析】本题主要考查弱酸电离及盐类水解。
(1)Na2B溶液显碱性,理由是(用离子方程式表示)B2-+H2O![]() HB-+OH-。
HB-+OH-。
(2)A.溶液中不存在H2B,故A错误;B.电荷守恒:c(Na+)+ c(H+)= c(HB–)+c(OH–) +2c(B2-),故B正确;C.从Na2B的组成比可得c(Na+)=2c(HB–) +2c(B2-),故C正确;D. 溶液中不存在H2B,故D错误。故选BC。
(3)已知0.1 mol/LNaHB溶液的pH=2,则0.1mol/LH2B溶液中c(H+)可能是<0.11mol/L,理由是H2B第一步电离产生的H+,抑制了HB-的电离。
(4)0.1mol/LNaHB溶液中pH=2表明HB-的电离程度大于水解程度,各种离子浓度大小为c(Na+)>c(HB–) >c(H+)>c(B2–)>c(OH–)。


科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1mol NO气体,干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的![]() ,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2
,干燥管中物质的质量增加2.24g随着CO2的继续通入,活塞又逐渐向右移动.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2![]() N2O4(不考虑活塞的摩擦)下列说法中正确的是( )
N2O4(不考虑活塞的摩擦)下列说法中正确的是( )
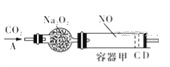
A. 活塞从D处移动到C处的过程中,通入CO2体积为2.24L(标准状况)
B. NO2转化为N2O4的转换率为20%
C. 活塞移至C处后,继续通入0.01mol CO2,此时活塞恰好回到D处
D. 若改变干燥管中Na2O2的量,要通过调节甲容器的温度及通入CO2的量,使活塞发生从D到C,又从C到D的移动,则Na2O2的质量应大于1.56g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一座巨大的化学资源宝库,从中可以提取许多常见的化学物质,结合所学知识回答下列问题,
(1)“吹出法”提溴空气吹出法是工业规模提溴的常用方法,其流程如下:

其中步骤②~④的目的是________________________________________________。步骤③反应的离子方程式为_______________________________________________。除SO2外,步骤③还可以选用Na2CO3溶液吸收溴,主要反应是Br2+Na2CO3+H2O→NaBr+NaBrO3+NaHCO3(未配平),吸收1molBr2时,转移电子的物质的量为__________________mol。
(2)实验室模拟从海带中提取碘,可能经历如下操作(或过程),请选择必要的操作(或过程),并按实验的先后顺序排列________________________________________________(填写编号)
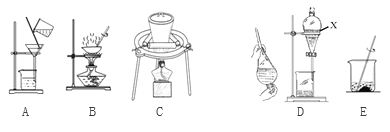
仪器X的名称__________________,将X中的液体分离的具体操作为:打开X上端玻璃塞,_______________________________________________________________________________。
(3)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。现以卤块为原料按下图流程制备轻质氧化镁,若要求产品尽量不含杂质,而且生产成本较低,请根据表1和表2提供的资料,回答下列问题:

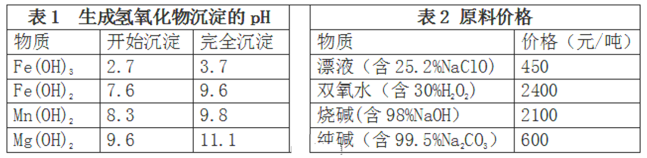
已知:Fe2+氢氧化物呈絮状,不易从溶液中除去。
步骤①反应的离子方程式为:___________________________________________________;
步骤②的反应方程式为:_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为从海带中提取碘的工业生产过程,有关说法错误的是
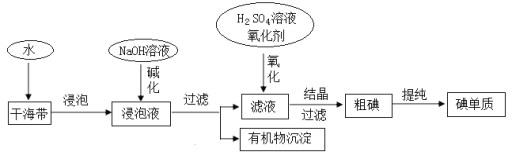
A.因海水中蕴藏着极其丰富的碘元素,所以工业上也可以直接用海水来提取碘元素
B.碱化操作时,加入NaOH溶液的原因是在碱性溶液中,可溶性有机质可形成沉淀
C.在实验室进行氧化操作时,加入的氧化剂可以是新制氯水、双氧水等
D.在实验室进行过滤操作时,需要用到玻璃仪器有玻璃棒、烧杯、漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决日益加剧的温室效应等问题,科学家正在研究建立如下图所示的二氧化碳新循环体系:
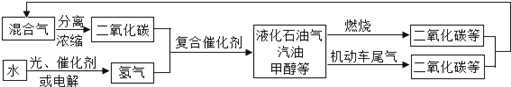
上述关系图能反映的化学观点或化学思想有:( )
①化学变化中元素种类是不变的;②燃烧时化学能可以转化为热能和光能;
③光能或电能可以转化为化学能;④无机物和有机物可以相互转化;
⑤二氧化碳可成为一种重要的资源。
A. ①②③④ B. ①②③⑤ C. ①②④⑤ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离方法不正确的是( )
A.用蒸馏的方法将自来水制成蒸馏水
B.用过滤的方法除去食盐水中的泥沙
C.用淘洗的方法从沙里淘金
D.用酒精萃取碘水中的碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液中粒子浓度关系正确的是( )
A. pH=1的NaHSO4溶液: c(H+)=c(SO![]() )+c(OH-)
)+c(OH-)
B. 含有AgCl和AgI固体的悬浊液: c(Ag+)>c(Cl-)=c(I-)
C. CO2的水溶液:c(H+)>c(HCO![]() )=2c(CO
)=2c(CO![]() )
)
D. 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O![]() )+c(C2O
)+c(C2O![]() )+c(H2C2O4)]
)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】制取漂白粉的反应为_______。漂白粉的主要成分为_______,有效成分为_______。漂白原理为_______,HClO不仅有漂白作用,还有消毒作用,HClO的不稳定性_______(用方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,R、W、X、Y、Z为元素周期表中前四周期的部分元素,下列有关叙述正确的是
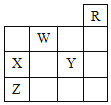
A. 五种元素中,只有Z为金属元素
B. W位于ⅥA族,有+6、-2两种常见化合价
C. X和Y的最高价氧化物对应水化物都是强酸
D. X、Y、Z的气态氢化物的稳定性:Y>X>Z
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com