
分析 氧化还原反应3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O中失电子的元素是铜和硫元素,化合价升高;得电子的元素是氮元素,化合价降低,转移的电子数目为6+3×8=30mol,当生成10molNO转移30mol电子,消耗22mol硝酸,被还原的硝酸为10mol,据此分析.
解答 解:(1)氧化还原反应3Cu2S+22HNO3=6Cu(NO3)2+3H2SO4+10NO↑+8H2O中失电子的元素是铜和硫元素,化合价升高;得电子的元素是氮元素,化合价降低,转移的电子数目为6+3×8=30mol,电子转移情况为: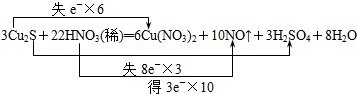 ,故答案为:
,故答案为: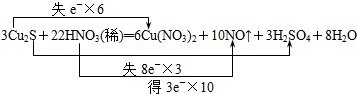 ;
;
(2)根据(1)的双线桥法标出电子转移的方向和数目,生成10molNO转移30mol电子,消耗22mol硝酸,被还原的硝酸为10mol,所以当产生0.1mol NO时,转移电子总数为0.3×6.02×1023,被还原的物质为0.1mol,共耗HNO3 0.22mol,故答案为:0.3×6.02×1023;0.1;0.22;
(3)根据得失电子守恒,被1mol Cu2S中+1价亚铜离子还原的HNO3的物质的量是$\frac{1×2}{3}$mol,故答案为:$\frac{2}{3}$.
点评 本题考查氧化还原反应,题目难度不大,本题注意从化合价变化的角度分析,易错点为(1),注意双线桥法的运用.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 | |
| B. | 该元素原子核外共有4个能层 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子最外层共有3个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
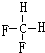 和
和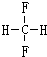
 和CH2=CH-CH2
和CH2=CH-CH2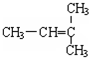 和
和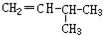
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 说法正确的是( )
说法正确的是( )| A. | 1 molA能与4 mol Ag(NH3)2OH溶液发生银镜反应 | |
| B. | 核磁共振氢谱图显示有三个吸收峰 | |
| C. | 不能与FeCl3溶液发生显色反应 | |
| D. | 1 mol A能与2 mol NaHCO3完全反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与氢氧化钠溶液:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com