
| A. | ①② | B. | ②④ | C. | ②③ | D. | ③④ |
分析 ①将SO2通入溴水中,二者发生氧化还原反应生成HBr和硫酸,溶液中氢离子浓度增大;
②将SO2通入品红溶液中,品红溶液图示,溶液中氢离子浓度基本不变;
③将H2S通入CuSO4溶液中,反应生成硫化铜沉淀和硫酸,氢离子浓度增大;
④将Cl2通入KI溶液,反应生成碘单质和氯化钾,溶液中氢离子浓度变化不大.
解答 解:①发生的反应为SO2+2Br2+2H2O=2HBr+H2SO4,溶液由强酸生成,导致溶液中氢离子浓度显著增大,故①错误;
②SO2能和有色物质品红溶液反应生成无色物质而体现漂白性,溶液中氢离子浓度变化不明显,故②正确;
③硫化氢与硫酸铜溶液反应生成硫化铜沉淀和硫酸,反应的离子方程式为:H2S+Cu2+=CuS↓+2H+,溶液中氢离子浓度明显增大,故③错误;
④该反应方程式为:Cl2+2KI=I2+2KCl,溶液中离子浓度变化不大,故④正确;
根据分析可知,反应发生后溶液中H+浓度未出现显著增大的为:②④,
故选B.
点评 本题考查元素化合物性质,为高频考点,题目难度中等,明确物质之间反应及物质性质是解本题关键,试题侧重考查学生的分析、理解能力及灵活应用能力.


 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
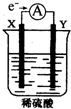 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )| A. | X极上发生的是还原反应 | |
| B. | 若两电极分别为Fe和碳棒,则Y为Fe | |
| C. | 若反应进行一段时间后,产生2克H2时转移了1mol电子 | |
| D. | 溶液中的SO42-向X极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将产物通过碱石灰,则不能被完全吸收 | |
| B. | 若将产物通过浓硫酸,充分吸收后,浓硫酸增重18g | |
| C. | 产物的平均摩尔质量为24g.mol-1 | |
| D. | 反应中消耗O256g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L•min | B. | 1 mol/L•min | C. | 0.5 mol/L•min | D. | 0.6 mol/L•min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置①常用于分离互不相溶的液体 | B. | 装置②可用于吸收NH3 | ||
| C. | 装置③可用于收集NO、CO2等气体 | D. | 装置④可用于制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 131I 原子的中子数为78 | B. | 131I 与127I互为同素异形体 | ||
| C. | 核裂变是一种化学变化 | D. | 碘在周期表中位于第四周期ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①③④ | C. | ②③④ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com