
【题目】某碱浸液中c(MoO42-)=0.80mol·L1,c(SO42-)=0.04 mol·L1,在结晶前需加入Ba(OH)2固体以除去溶液中的SO42-。当BaMoO4开始沉淀时,SO42-的去除率是( )
[Ksp(BaSO4)=1.1× 1010、Ksp(BaMoO4)=4.0 ×108,溶液体积变化可忽略不计]
A. 79.6%B. 85.6%C. 94.5%D. 98.9%
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知煤的近代结构模型如图所示。
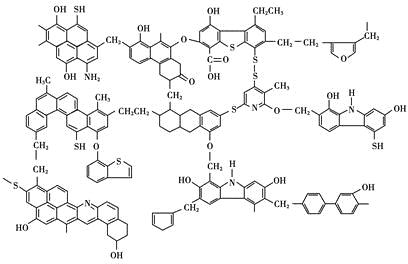
回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
利用甲烷与氯气发生取代反应的副产品生产盐酸的设想在工业上已成为现实。某化学兴趣小组拟在实验室中模拟上述过程,所设计的装置如下图所示:
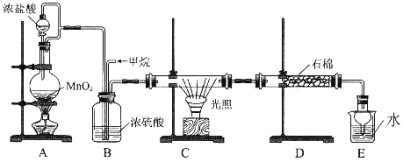
(1)最简单烷烃的空间结构为_______________。
(2)写出装置C中生成一氯甲烷的化学方程式:__________,该反应类型为:_________。
(3)D中石棉上吸附着潮湿的KI粉末,其作用是_________________________。
(4)若题目中甲烷与氯气的体积之比为1∶1,两者反应则得到的产物有____种,其中常温下为气态的有机产物的化学式为:________。
(5)将0.4molCH4与Cl2发生取代,测得4种有机取代物的物质的量相等,则消耗的氯气的物质的量是______________。
(6)烃A为甲烷的同系物,A中有12个氢原子,写出A的同分异构体中,含4个-CH3的结构简式: _________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释工业生产或应用的化学用语中,不正确的是( )
A. FeCl3溶液刻蚀铜电路板:2Fe3+ + Cu==2Fe2++ Cu2+
B. 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O== Al(OH)3↓ + 3NH4 +
C. 将少量二氧化碳通入次氯酸钠溶液中:CO2+H2O+2ClO-== CO32-+2HClO
D. Na2CO3溶液处理水垢:CaSO4(s)+CO32(aq)![]() CaCO3(s)+SO42(aq)
CaCO3(s)+SO42(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。不考虑空间构型,[B(OH)4]-的结构可用示意图表示为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下:
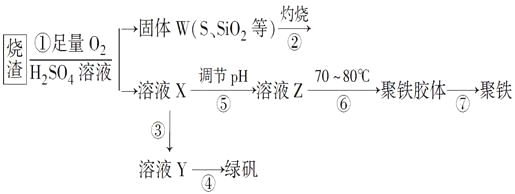
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是________。
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的离子方程式为:________。
(3)过程③中,需加入的物质是________。
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有___________。
(5)过程⑤调节pH可选用下列试剂中的________(填选项序号)。
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70~80℃,目的是___________。
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.800 g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495 g。若该聚铁主要成分为[Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为________。(假设杂质中不含铁元素和硫元素)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中加入过量Na2O2后仍能大量共存的是
A.NH![]() 、Ba2+、Cl-、NO
、Ba2+、Cl-、NO![]() B.K+、SiO
B.K+、SiO![]() 、AlO
、AlO![]() 、SO
、SO![]()
C.Fe2+、Mg2+、SCN-、Cl-D.Na+、SO![]() 、I-、HCO
、I-、HCO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在密闭容器中SO2、O2、SO3三种气态物质建立化学平衡后,改变条件对反应2SO2(g)+O2(g)2SO3(g) ΔH<0的正、逆反应速率的影响如图所示:
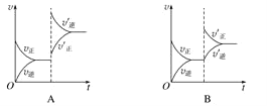
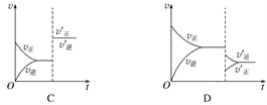
(1)加催化剂对反应速率影响的图象是__________(填字母,下同),平衡__________移动。
(2)升高温度对反应速率影响的图象是__________,平衡向__________方向移动。
(3)增大反应容器体积对反应速率影响的图象是__________,平衡向__________方向移动。
(4)增大O2的浓度对反应速率影响的图象是__________,平衡向__________方向移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属镍在电池、合金、催化剂等方面应用广泛.
(1)下列关于金属及金属键的说法正确的是_____.
a.金属键具有方向性与饱和性
b.金属键是金属阳离子与自由电子间的相互作用
c.金属导电是因为在外加电场作用下产生自由电子
d.金属具有光泽是因为金属阳离子吸收并放出可见光
(2)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是____.
(3)过滤金属配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=___.CO与N2结构相似,CO分子内σ键与π键个数之比为______.
(4)甲醛(H2C═O)在Ni催化作用下加氢可得甲醇(CH3OH).甲醇分子内C原子的杂化方式为_____,甲醇分子内的O﹣C﹣H键角____(填“大于”“等于”或“小于”)甲醛分子内的O﹣C﹣H键角.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com