
【题目】水合草酸亚铁(FeC2O4·xH2O)是生产锂电池的原料。难溶于水,受热易分解。某化学兴趣小组对草酸亚铁的一些性质进行探究。回答下列问题:
(1)将水合草酸亚铁溶于适量盐酸。分别取2 mL此溶液于3支试管中,进行实验。能证明水合草酸亚铁中存在Fe2+的试剂有____(填代号)。
A.KSCN溶液 B.K3[Fe(CN)6]溶液 C.酸性KMnO4溶液
(2) 为测定水合草酸亚铁中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为m2 g。按下图连接好装置进行实验。
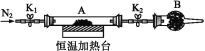
实验步骤如下:
a.打开K1和K2,缓缓通入N2; b.低温加热装置A一段时间;
c.停上加热,冷却到室温; d.关闭K1和K2,称量A;
e. ,记为m3 g。
①补充实验步骤e为__________(填实验操作和要求)。
②步骤b至步骤e继续通入N2的目的是___________________。
(3)为探究草酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示部分的装置(可重复选用)进行实验。打开K1和K2,缓缓通入N2,充分加热。实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物。
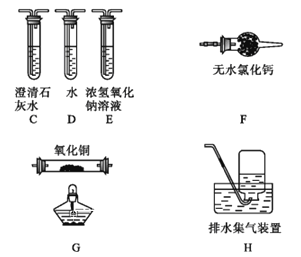
①实验装置中,依次连接的合理顺序为A→_______________。
②证明产物有CO生成的现象是________________。
③写出草酸亚铁受热分解的化学方程式________________。
【答案】B重复上述a~d步骤,直至A恒重。将装置A中的水蒸气带走;同时防止FeC2O4被空气氧化。C→E→C→F→G→C→HG装置黑色固体变红,其后的C中澄清石灰水变浑浊3FeC2O4![]() Fe3O4+4CO↑+2CO2↑
Fe3O4+4CO↑+2CO2↑
【解析】
(1)A. KSCN溶液加到亚铁盐溶液中没有明显的现象,故A错误;B.K3[Fe(CN)6]溶液与亚铁离子反应生成蓝色沉淀,故B正确;C.酸性KMnO4溶液能够被亚铁离子和草酸跟离子还原褪色,不能说明有一定含有亚铁离子,故C错误;故选B;
(2)①实验过程为:a.打开K1和K2,缓缓通入N2;b.低温加热装置A一段时间;c.停上加热,冷却到室温;d.关闭K1和K2,称量A;e.重复上述a~d步骤,直至A恒重;②氮气不参加反应,为保护气体,考虑到实验目的是测定水合草酸亚铁中结晶水含量,所以通入氮气有两个目的;将装置A中的水蒸气带走;同时防止FeC2O4被空气氧化;
(3)①加热分解草酸亚铁生成一氧化碳和二氧化碳,则实验应验证一氧化碳和二氧化碳,先验证二氧化碳,可用澄清石灰水;然后除去二氧化碳、并检验二氧化碳已除尽;接着验证一氧化碳,可用还原氧化铜实验。所以连接装置顺序为: C(验证二氧化碳)→E(除去二氧化碳)→C(验证二氧化碳被除净)→F(干燥气体)→G(验证一氧化碳)→C(验证一氧化碳被氧化成二氧化碳)→H(尾气收集);②证明产物有CO生成的现象是G装置黑色固体变红,其后的C中澄清石灰水变浑浊;③实验后石英玻璃管中固体仅残留一种有磁性的黑色化合物,此黑色化合物为四氧化三铁,因此,加热后草酸亚铁分解,生成物为一氧化碳和二氧化碳和四氧化三铁,该反应的化学方程式为:3FeC2O4![]() Fe3O4+4CO↑+2CO2↑。
Fe3O4+4CO↑+2CO2↑。


 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的的是
选项 | 实验方案 | 实验目的 |
A |
| 验证FeCl3对H2O2分解反应有催化作用 |
B |
将NO2球浸泡在冰水和热水中 | 探究温度对平衡2NO2 |
C |
| 除去CO2气体中混有的SO2 |
D |
| 比较HCl、H2CO3和H2SiO3的酸性强弱 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯二氧化硅可用下列流程制得.下列说法不正确的是
![]()
A. X可用作木材防火剂
B. 步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3(胶体)+ Na2SO4
C. 步骤Ⅱ中的稀硫酸可用CO2来代替
D. SiO2既能与盐酸反应,又能与氢氟酸反应,所以SiO2是两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。下列有关说法正确的是( )

A. 关闭 K1,打开 K2,试剂 X 是酸性 KMnO4 或 FeCl3 溶液,均可证明 SO2 有还原性
B. 关闭 K2,打开 K1,滴加硫酸,则装置 B 中每消耗 1molNa2O2,转移电子数为NA
C. 为防止环境污染,装置C和E中的试剂均取用饱和的石灰水
D. 实验过程中体现了硫酸的酸性、吸水性、难挥发性、强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化硼的熔点为-107.3 ℃,沸点为12.5 ℃,易水解生成硼酸(H3BO3),可用于制造高纯硼、有机合成催化剂等。实验室制取三氯化硼的原理为B2O3+3C+3Cl2![]() 2BCl3+3CO。
2BCl3+3CO。
(1)甲组同学拟用下列装置制取纯净干燥的氯气(不用收集)。

①装置B中盛放的试剂是__,装置C的作用是___________________。
②装置A中发生反应的离子方程式为 _____________________________。
(2)乙组同学选用甲组实验中的装置A、B、C和下列装置(装置可重复使用)制取BCl3并验证反应中有CO生成。
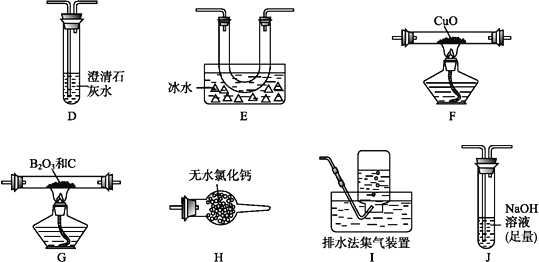
①乙组同学的实验装置中,依次连接的合理顺序为
A→B→C→G→__→__→__→__→F→D→I。
②能证明反应中有CO生成的现象是___________________________。
③开始实验时,先点燃____(填“A” 或“G”)处的酒精灯。
④请写出BCl3水解的化学方程式__________________________。
⑤硼酸是一元弱酸,其钠盐化学式为Na [B(OH)4],则硼酸在水中电离方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:HCN(aq)与NaOH(aq)反应的△H=-12.1kJ /mol;HCl(aq)与NaOH(aq)反应的△H =-55.6kJ/ mol。则HCN在水溶液中电离的ΔH等于
A. -67.7 kJ /mol B. -43.5kJ /mol C. +43.5 kJ/ mol D. +67.7 kJ/ mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NH4Cl和Ca(OH)2制取氨气,下图A和B是常用的气体发生装置。

(1)实验室制氨气时反应的化学方程式是______________________________________,应选用的装置是_____;若改用浓氨水和NaO固体制氨气时,应选取的装置是________。
(2)为了得到干燥的氨气,实验室常使用________做干燥剂(请从碱石灰、浓硫酸、氯化钠中选出一种物质)。
(3)实验室常用_______法收集氨气。在标准状况下,将盛满氨气的集气瓶倒置于水中(假设溶质全部在集气瓶内),则所得溶液的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计下列方案对A盐的水解液进行鉴定:![]() 由此得出的结论中,不正确的是
由此得出的结论中,不正确的是
A. D溶液中存在Fe(SCN)3 B. A一定为无氧酸盐FeBr2 C. B为AgBr D. 滤液中有Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 三硝基甲苯的分子式为C7H3N3O6
B. 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少
C.  在核磁共振氢谱中能出现两个峰,且其峰面积之比为3∶1
在核磁共振氢谱中能出现两个峰,且其峰面积之比为3∶1
D. 2,3-二甲基丁烷的核磁共振氢谱中会出现两个峰
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com