
储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢:
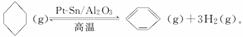 在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
在某温度下,向恒容密闭容器中加入环己烷,其起始浓度为a mol·L-1,平衡时苯的浓度为b mol·L-1,该反应的平衡常数K=________。
科目:高中化学 来源: 题型:
甲气体可发生如下变化:甲气体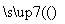 乙气体
乙气体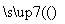 丙气体
丙气体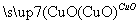 乙气体
乙气体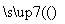 丁固体。则甲、乙、丙、丁分别为( )
丁固体。则甲、乙、丙、丁分别为( )
A.CO2、CO、O2、CaO
B.O2、CO、CO2、CaCO3
C.O2、CO2、CO、CaCO3
D.CO、CO2、O2、Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
实验证明,多数能自发进行的反应都是放热反应。对此说法的理解正确的是( )
A.所有的放热反应都是自发进行的
B.所有的自发反应都是放热的
C.焓变是影响反应是否具有自发性的一种重要因素
D.焓变是决定反应是否具有自发性的唯一判据
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,某反应达平衡时平衡常数K=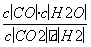 。恒容时,温度升高,H2的浓度减小。下列说法正确的是( )
。恒容时,温度升高,H2的浓度减小。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2的浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2OCO2+H2
查看答案和解析>>
科目:高中化学 来源: 题型:
在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)M(g)+N(g),所得实验数据如下表:
| 实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是( )
A.实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min 时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡时,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
最新“人工固氮”的研究报道:常温常压、光照条件下,N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)4NH3(g)+3O2(g) ΔH>0,如果反应的平衡常数K值变大,则下列说法错误的是( )
A.一定向正反应方向移动
B.在平衡移动时正反应速率先增大后减小
C.改变的外界条件是升温
D.在平衡移动时逆反应速率先减小后增大
查看答案和解析>>
科目:高中化学 来源: 题型:
在300 ℃时,改变起始反应物中n(H2)对反应N2(g)+3H2(g)2NH3(g) ΔH<0的影响如图所示,下列说法正确的是( )
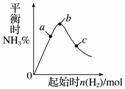
A.反应在b点达到平衡
B.b点H2的转化率最高
C.c点N2的转化率最高
D.a、b、c三点的平衡常数Kb>Ka>Kc
查看答案和解析>>
科目:高中化学 来源: 题型:
不同元素的气态原子失去最外层一个电子所需要的能量(设其为E)如图所示。
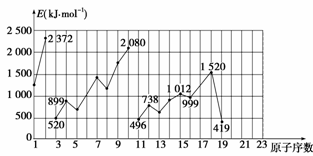
试根据元素在同期表中的位置,分析图中曲线的变化特点,并回答下列问题。
(1)同主族内不同元素的E值变化的特点是_________________________________。各主
族中E值的这种变化特点体现了元素性质的____________变化规律。
(2)同周期内,随原子序数增大,E值增大。但个别元素的E值出现反常现象。试预测下列关系式中正确的是________(填写编号,多选倒扣)。
①E(砷)>E(硒) ②E(砷)<E(硒)
③E(溴)>E(硒) ④E(溴)<E(硒)
(3)估计1 mol气态Ca原子失去最外层一个电子所需能量E值的范围:
_____<E<____________。
(4)10号元素E值较大的原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
答案 AB
解析 水分子中各原子已达到稳定结构,H3O+是H+和H2O中的O形成配位键;[B(OH)4]-是3个OH-与B原子形成3个共价键,还有1个OH-的O与B形成配位键;其他项均不能形成配位键。
★ ★★
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com