
| A. | 向CuSO4溶液中加入NaOH溶液得到的分散系 | |
| B. | 向水中加入食盐得到的分散系 | |
| C. | 向沸水中滴入FeCl3饱和溶液得到的红褐色液体 | |
| D. | 向澄清的石灰水中通入少量二氧化碳气体得到的分散系 |
分析 根据分散质粒子直径大小分类,把分散系分为:溶液、胶体、浊液,溶液、浊液、胶体的本质区别就是分散质的微粒直径不同,溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以溶液的分散质粒子直径最小结合各选项物质的类别即可解答.
解答 解:溶液、浊液、胶体的本质区别就是分散质的微粒直径不同,溶液(小于1nm)、胶体(1nm~100nm)、浊液(大于100nm),所以溶液的分散质粒子直径最小.
A.向CuSO4溶液中加入NaOH溶液得到的分散系属于悬浊液,分散质微粒半径大于100nm,故A错误;
B.向水中加入食盐得到的分散系,属于溶液分散系,分散质微粒半径小于1nm,故B正确;
C.向沸水中滴入FeCl3饱和溶液得到的红褐色液体,属于胶体分散系,分散质微粒半径1nm~100nm,故C错误;
D.向澄清的石灰水中通入少量二氧化碳气体得到的分散系,属于浊液分散系,分散质微粒半径大于100nm,故D错误;
故选B.
点评 本题主要考查了分散系的分类依据,明确分类标准是解题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | H+、NO3-、Na+、SO32- | B. | Ag+、Fe3+、Cl-、SO42- | ||
| C. | K+、SO42-、Cu2+、OH- | D. | Na+、Cl-、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30 g/mol | B. | 60 g/mol | C. | 90g/mol | D. | 120 g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭在空气中燃烧发白光、放热 | |
| B. | 氧化反应是指物质与氧气发生的化合反应 | |
| C. | 凡是在空气中不能燃烧的物质,在纯氧中也不能燃烧 | |
| D. | 蜡烛燃烧、食物腐败都是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ).
).
 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
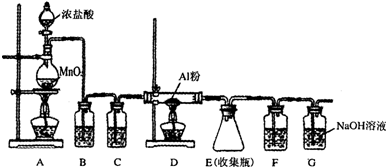
 醋酸亚铬水合物{[Cr(CH3COO)2)]2•2H2O,深红色晶体}是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,易溶于乙醇和盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:
醋酸亚铬水合物{[Cr(CH3COO)2)]2•2H2O,深红色晶体}是一种氧气吸收剂,通常以二聚体分子存在,不溶于冷水和醚,易溶于乙醇和盐酸.实验室制备醋酸亚铬水合物的装置如图所示,涉及的化学方程式如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com