
分析 质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多;C元素质量分数越大生成二氧化碳越多,以此来解答.
解答 解:CH4、C2H2、C2H4、C2H6和C3H8的H%大小为:CH4>C2H6>C3H8>C2H4>C2H2,质量相同时,分子中H元素的质量分数越大,完全燃烧时消耗O2越多,故完全燃烧时消耗O2的量最多的是CH4;
CH4、C2H2、C2H4、C2H6和C3H8的C%大小为:CH4<C2H6<C3H8<C2H4<C2H2,质量相同时,分子中C元素的质量分数越大,完全燃烧时生成的CO2越多,故完全燃烧生成的CO2最多的是C2H2,
故答案为:CH4;C2H2.
点评 本题考查有机物燃烧反应的计算,为高频考点,把握H的质量分数、C的质量分数比较为解答的关键,侧重分析与计算能力的考查,注意规律性方法的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题
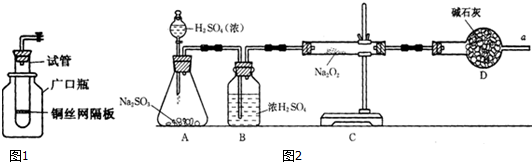
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.0gCuO和Cu2S的混合物含铜原子个数为0.2NA | |
| B. | 标准状况下,11.2 L乙醇蒸气含共价键数目为4NA | |
| C. | 1mol K与O2完全反应生成K2O、K2O2、KO3的混合物,转移电子数为NA | |
| D. | 1L 0.2 mol•L-1 NH4ClO4溶液中含NH4+数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH相同的CH3COONa溶液、C6H5ONa溶液、Na2CO3溶液、NaOH溶液:c(CH3COONa)>c(C6H5ONa )>c(Na2CO3)>c(NaOH ) | |
| B. | 在常温下,10 mL 0.02 mol•L-1HCl溶液与10 mL 0.02 mol•L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10 | |
| C. | 将pH=3的一元弱酸HA和pH=11的NaOH溶液充分混合后一定有:c(OH-)<c(H+)<c(Na+)<c(A-) | |
| D. | 将0.2 mol•L-1的盐酸与0.1 mol•L-1的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
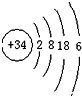 推测硒在元素周期表中第四周期;
推测硒在元素周期表中第四周期;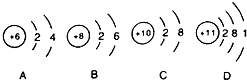
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅单质可用来制造太阳能电池 | |
| B. | 装碱性溶液的玻璃试剂瓶不能用玻璃塞 | |
| C. | 二氧化硅是制造光导纤维的材料 | |
| D. | 自然界硅元素的贮量丰富,并存在大量的单质硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
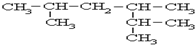
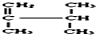 系统名称为2,3-二甲基-1-丁烯;
系统名称为2,3-二甲基-1-丁烯;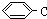 ≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个.
≡C-CH=CH-CH3,共面的碳原子最多有12个,共线的碳原子最多有6个. 表示的分子式C6H14.
表示的分子式C6H14.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
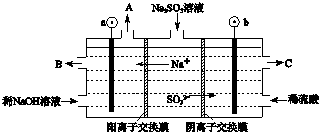
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com