


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
| A、标准状况下,0.5 mol SO3中含有1.5NA个O原子 |
| B、常温常压下,22 g 14CO2中所含分子数为0.5NA |
| C、室温下,1 L pH=1的H2SO4溶液中含有的H+数目为0.2NA |
| D、7.8g Na2O2与足量水反应,转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 L溶液中阴阳离子总数为1.2NA |
| B、500 mL溶液中NO3-浓度为0.2 mol/L |
| C、500 mL溶液中Ba2+浓度为0.2 mol/L |
| D、500 mL溶液中NO3-物质的量为0.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
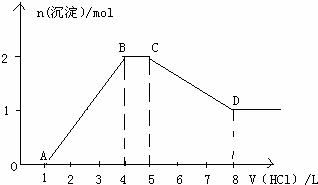
| 阴离子种类 | |||||
| 物质的量浓度(mol/L) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
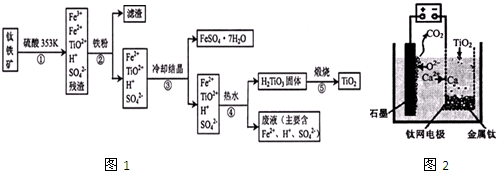
查看答案和解析>>
科目:高中化学 来源: 题型:
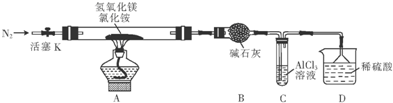
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
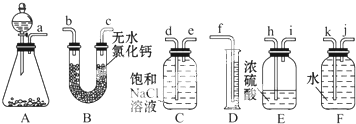
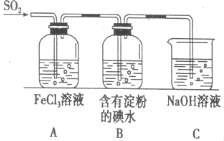 SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:
SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,具有一定的还原性,探究SO2气体还原Fe3+、I2可以使用的药品和装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com