
| 已知 | 类推 | |||||||||
| A | 将Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+ | ||||||||
| B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性:2H++SO42-+Ba++2OH-=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性:2H++SO42-+Ba++2OH-=BaSO4↓+2H2O | ||||||||
| C | 铁和氯气反应2Fe+3Cl2
|
铁和单质反应2Fe+3I2
| ||||||||
| D | 向Ca(ClO)2溶液中通入少量CO2:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
| A、A | B、B | C、C | D、D |


科目:高中化学 来源: 题型:
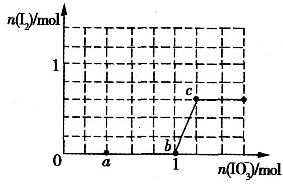 已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.请回答下列问题:
已知溶液中,还原性为HSO3->I-,氧化性为IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由水电离产生的c(H+)=1×10-2mol?L-1溶液中,可能存在:CO32-、NH4+、Cl-,Na+ |
| B、某醋酸稀溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| C、Ba(OH)2溶液中加人过量的Al2(SO4)3溶液,其离子方程式为:3Ba2++60H-+2Al3++3SO42-=3BaS04↓+2Al(0H)3↓ |
| D、物质的量浓度均为1mol?L-1的NaCl和MgCl2混合液中,含有Cl-的数目为3NA(NA表示阿伏加德罗常数的值) |
查看答案和解析>>
科目:高中化学 来源: 题型:
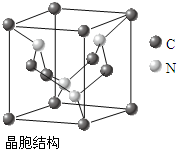 [化学-物质结构与性质]
[化学-物质结构与性质]| A-B | A=B | A≡B | |
| CO | 357.7 | 798.9 | 1071.9 |
| N2 | 154.8 | 418.4 | 941.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定温度下,pH=6的纯水中含有的 OH-数为 10-6 NA |
| B、1 L 0.1 mol?L-1的醋酸溶液中含有的离子和分子的总数为 0.1 NA |
| C、1.2 g NaHSO4晶体中含有的阳离子和阴离子的总数为 0.03 NA |
| D、常温常压下,56 g乙烯和丙烯的混合气中含有的碳原子数为 4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| O | 2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
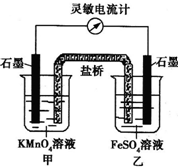 已知氧化还原反应:2KMn04+10FeS04+8H2SO4?2MnS04+5Fe2(S04)3+K2S04+8H2O.控制适当的条件,将上述反应设计成如图所示的原电池.下列判断不正确的是( )
已知氧化还原反应:2KMn04+10FeS04+8H2SO4?2MnS04+5Fe2(S04)3+K2S04+8H2O.控制适当的条件,将上述反应设计成如图所示的原电池.下列判断不正确的是( )| A、随着反应进行,甲中颜色逐渐变浅,乙中颜色逐渐变深 |
| B、反应开始时,甲中石墨电极上的电极反应式为Mn04-+8H++5e-═Mn2++4H20 |
| C、反应开始时,乙中石墨电极上发生还原反应 |
| D、电流计读数为零时,反应达到化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 I.飞机尾气中的NO会破坏臭氧层.利用催
I.飞机尾气中的NO会破坏臭氧层.利用催| 实验编号 | T(℃) | NO初始浓度(mol/L) | CO初始浓度(mol/L) | 催化剂的比表面积(m2/g) |
| Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| Ⅱ | 1.20×10-3 | 124 | ||
| Ⅲ | 350 | 5.80×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 Fe3++2 I-→2 Fe2++I2 |
| B、2 NO3-+6 I-+8 H+→2 NO↑+3 I2+4 H2O |
| C、5 NO3-+Fe3++16 I-+20 H+→Fe2++5 NO↑+8 I2+10 H2O |
| D、2 NO3-+4 Fe3++10 I-+8 H+→4 Fe2++2 NO↑+5 I2+4 H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com