
���ڴ�������Ϊ��ѧ��ҵ����������ľ���Ч�棬�����о���Ѱ��һֱ���ܵ����ӵĸ߿Ƽ�����
��1��V2O5�ǽӴ���������Ĵ�������ͼΪ��������������2SO2 (g) + O2(g) 2SO3(g) ��H����196.6 kJ��mol��1��Ӧ���̵������仯ʾ��ͼ��
2SO3(g) ��H����196.6 kJ��mol��1��Ӧ���̵������仯ʾ��ͼ��
��V2O5��ʹ�û�ʹͼ��B�� ������ߡ��������͡�����
��һ�������£�SO2�������Ӧtmin��SO2��SO3���ʵ���Ũ�ȷֱ�Ϊa mol/L��b mol/L����SO2��ʼ���ʵ���Ũ��Ϊ mol/L������SO3�Ļ�ѧ��Ӧ����Ϊ mol/(L��min)��
��2����ͼ��һ����ͭ��ϡ����Ϊԭ��������������������ʾ��ͼ��
������CuSO4���ܷ�ӦΪ2Cu+O2+2H2SO4��2 CuSO4+2H2O������ ������ã�ʹ��Ӧ������������ɣ�
������ã�ʹ��Ӧ������������ɣ�
��һ����Cu��2Fe3����2Fe2����Cu2��
�ڶ����� ���������ӷ���ʽ��ʾ��
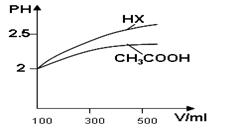
�ڵ�����ҺpHΪ3��4��Ŀ���� ������ʱ������Լ�����Ϊ ����ѡ����ţ�
a��NaOH��Һ b��CuO��ĩ c��Cu2(OH)2CO3 d����ˮ
��3������TiO2�������Ĺ�����������ҵ�����������Ƶô�TiO2����ת��ΪTiCl4(l)����TiCl4(l)��ȡ����TiO2�ķ���֮һ�ǽ�TiCl4���嵼�����������У�700��1000�棩����ˮ�⡣
��֪��TiO2(s)��2Cl2(g)��TiCl4(l)��O2(g) ��H����140 kJ��mol��1
2C(s)��O2(g)��2CO(g) ��H����221 kJ��mol��1
��д��TiO2�ͽ�̿��������Ӧ����TiCl4��CO���Ȼ�ѧ����ʽ�� ��
��д������TiCl4(l)��ȡ����TiO2�Ļ�ѧ����ʽ�� ��
��1���ٽ���(1��) ��a+b(1��)  (1��) ��2�� ��4Fe2����O2��4H����4Fe3����2H2O (2��)
(1��) ��2�� ��4Fe2����O2��4H����4Fe3����2H2O (2��)
�ڽ�Fe3+ת��ΪFe(OH)3������ȥ(1��) b,c(2��)
��3����TiO2(s)��2Cl2(g)��2C(s)��TiCl4(l)��2CO(g) ��H����81 kJ��mol��1(2��)
��TiCl4+2H2O TiO2+4HCl(2��)
TiO2+4HCl(2��)
���������������1���ٴ����ܽ��ͷ�Ӧ�Ļ�ܣ�����V2O5��ʹ�û�ʹͼ��B�㽵�͡�
��һ�������£�SO2�������Ӧtmin��SO2��SO3���ʵ���Ũ�ȷֱ�Ϊa mol/L��b mol/L�������Sԭ���غ��֪��SO2��ʼ���ʵ���Ũ��Ϊ��a��b��mol/L����Ӧ����ͨ���õ�λʱ����Ũ�ȵı仯������ʾ����������SO3�Ļ�ѧ��Ӧ����Ϊ mol/(L��min)��
mol/(L��min)��
��2�������ڴ����ڷ�Ӧǰ�䣬��˸����ܷ�Ӧʽ�͵�һ����Ӧʽ��֪���ܷ�Ӧʽ��ȥ��һ����Ӧʽ���õ��ڶ�����Ӧʽ�����ڶ�����ӦʽΪ4Fe2����O2��4H����4Fe3����2H2O
��������Һ�к��������ӣ����������ͭ���Ʊ��������Ҫ�������ӳ�ȥ�����Ե�����ҺpH��Ŀ�ľ��ǽ�Fe3+ת��ΪFe(OH)3������ȥ������Ϊ�ڳ�ȥ�����ӵ�ͬʱ�������������µ����ʣ���˲��� ѡ���������ƺͰ�ˮ��Ӧ��ѡ������ͭ���ʽ̼��ͭ������ѡbc��
��3������֪��Ӧ��TiO2(s)��2Cl2(g)��TiCl4(l)��O2(g) ��H����140 kJ��mol��1����2C(s)��O2(g)��2CO(g) ��H����221 kJ��mol��1������ݸ�˹���ɿ�֪�٣��ڼ��õ���ӦTiO2(s)��2Cl2(g)��2C(s)��TiCl4(l)��2CO(g)�����Ը÷�Ӧ�ķ�Ӧ�Ȧ�H��140 kJ��mol��1��221 kJ��mol��1����81 kJ��mol��1��
�ڸ���TiCl4(l)��ȡ����TiO2�ķ���֮һ�ǽ�TiCl4���嵼�����������У�700��1000�棩����ˮ���֪��TiCl4(l)��ȡ����TiO2�Ļ�ѧ����ʽΪTiCl4+2H2O TiO2+4HCl��
TiO2+4HCl��
���㣺��������Ի�ܵ�Ӱ�졢��Ӧ���ʼ��㣻���ʵķ������ᴿ����Ӧ�ȵļ����Լ������Ʊ���


 ��������ϵ�д�
��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
���״���һ�����͵���������ȼ�ϣ���ҵ�Ͽ�ͨ��CO��H2�����Ʊ��״����÷�Ӧ���Ȼ�ѧ����ʽΪ��CO(g)+2H2(g) CH3OH(g) ��H
CH3OH(g) ��H
��֪ijЩ��ѧ���ļ����������±���
| ��ѧ�� | C��C | C��H | H��H | C��O | C��O | H��O |
| ����/kJ��mol��1 | 348 | 413 | 436 | 358 | 1072 | 463 |
| ��Ӧʱ��/min | 0 | 5 | 10 | 15 | 20 | 25 |
| ѹǿ/MPa | 12��6 | 10��8 | 9��5 | 8��7 | 8��4 | 8��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����֪����Fe(s)+1��2O2(g)=FeO(s) ��H1=-272.0KJ��mol-1
��2Al(s)+3��2(g)=Al2O3(s) ��H2=-1675.7KJ��mol-1
Al��FeO�������ȷ�Ӧ���Ȼ�ѧ����ʽ��__ __��
ijͬѧ��Ϊ�����ȷ�Ӧ�����ڹ�ҵ����������ж���_ (��ܡ����ܡ�)��������� 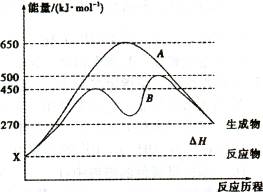
��2����Ӧ�����������Ϊ��̬��ij���淴Ӧ�ڲ�ͬ�����µķ�Ӧ���̷ֱ�ΪA��B����ͼ��ʾ���پ�ͼ�жϸ÷�Ӧ�� (������š� )�ȷ�Ӧ������Ӧ�ﵽƽ��������������䣬�������¶ȣ���Ӧ���ת���ʽ� (����� ����С�����䡱)��
������B���̱����˷�Ӧ���õ�����Ϊ
(����ĸ)��
A.�����¶� B.����Ӧ���Ũ��
C.�����¶� D.ʹ�ô���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��11�֣��о�ȼ�ϵ�ȼ�պͶ���Ⱦ���������������������ڷ�ֹ������Ⱦ����Ҫ���塣
��1����úת��Ϊ�������ȼ�ϣ�
��֪��H2(g)+1/2O2(g)=H2O(g)  H= ?241��8kJ/mol
H= ?241��8kJ/mol
C(s)+1/2O2(g)=CO(g)  H= ?110��5kJ/mol
H= ?110��5kJ/mol
д����̿��ˮ������Ӧ��H2��CO���Ȼ�ѧ����ʽ ��
��2��һ�������£����ܱ������ڣ�SO2��������SO3���Ȼ�ѧ����ʽΪ��2SO2(g)+O2(g) 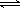 2SO3(g)��
2SO3(g)��
��H=?a kJ/mo1������ͬ������Ҫ��õ�2akJ��������������ʵ����ʵ���������
A��4mo1 SO2��2mol O2���������� B��4mol SO2��2mo1 O2��2mol SO3
C��4mol SO2��4mo1 O2������ D��6mo1 SO2��4mo1 O2
��3������β����NOx��CO�����ɼ�ת����
����֪����������NO�ķ�ӦΪ��N2(g)+O2(g)  2NO(g)
2NO(g)  H��0
H��0
��һ���¶��µĶ����ܱ������У���˵���˷�Ӧ�Ѵ�ƽ�����
A��ѹǿ���� B���������ƽ����Է�����������
C��2v��(N2)��v��(NO) D�� N2������������ٸı�
������ȼ�Ͳ���ȫȼ��ʱ����CO���������밴���з�Ӧ��ȥCO��2CO(g)=2C(s)+O2(g)  H��0��
H��0��
�����������ܷ�ʵ�ֵ����� ��
��4��ȼ��CO��H2��һ�������¿����ת����CO(g)��H2O(g)  CO2(g)��H2(g)����420��ʱ��ƽ�ⳣ��K=9������Ӧ��ʼʱ��CO��H2O��Ũ�Ⱦ�Ϊ0��1mol/L����CO�ڴ˷�Ӧ�����µ�ת����Ϊ ��
CO2(g)��H2(g)����420��ʱ��ƽ�ⳣ��K=9������Ӧ��ʼʱ��CO��H2O��Ũ�Ⱦ�Ϊ0��1mol/L����CO�ڴ˷�Ӧ�����µ�ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��1����ҵ��һ������������ַ�Ӧ�ϳɼ״���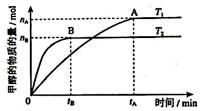
��ӦI�� CO(g)+2H2(g) CH3OH(g) ��H1
CH3OH(g) ��H1
��ӦII�� CO2(g)+3H2(g) CH3OH(g)+ H2O(g) ��H2
CH3OH(g)+ H2O(g) ��H2
��������Ӧ���ϡ�ԭ�Ӿ��á�ԭ����� (�I����)��
���������������������£������¶ȶԷ�ӦII��Ӱ�죬ʵ������ͼ��ʾ
��ͼ�������ж� ��H2 0 (���������=������)��
��ij�¶��£���2 mol CO2��6 mol H2����2L���ܱ������У�������ӦII���ﵽƽ����c(CO2)= 0��2 mol/L�� ���ʱ�����е�ѹǿΪԭ���� ��
��2����֪�ڳ��³�ѹ�£�
�� 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ��H =-1275��6 kJ/mol
�� 2CO (g)+ O2(g) = 2CO2(g) ��H =-566��0 kJ/mol
�� H2O(g) = H2O(l) ��H =-44��0 kJ/mol
�����1 mol�״�����ȫȼ������1 molһ����̼��Һ̬ˮ�ų�������Ϊ ��
��3��ijʵ��С�����ݼ״�ȼ�յķ�Ӧԭ���������ͼ��ʾ�ĵ��װ�ã�
�ٸõ�ظ����ĵ缫��ӦΪ
�ڴ˵�����ļ״�1��6��ʱ����Ӧ�е���ת����ĿΪ
�����Դ�ȼ�ϵ��ΪǦ���س�磬��Ӧ��ͼ���Ҳ�缫�������ص� (��������)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��˹�����������Ϳ�ѧ�о����к���Ҫ�����塣��Щ��Ӧ�ķ�Ӧ����Ȼ��ֱ�Ӳ�ã�����ͨ����ӵķ����ⶨ���ָ�������3���Ȼ�ѧ��Ӧ����ʽ��
��Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)��H���D24��8kJ?mol-1
��3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)��H���D47��2kJ?mol-1
��Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)��H��+640��5kJ?mol-1
д��CO���廹ԭFeO����õ�Fe�����CO2������Ȼ�ѧ��Ӧ����ʽ��__________________________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪��������ͨ����������S8(б����)����ʽ���ڣ���������״̬ʱ������S2��S4��S6��S8�ȶ���ͬ�������壬����S4��S6��S8�������ƵĽṹ�ص㣬��ṹ����ͼ��ʾ��
��һ�������£�S8(s)��O2(g)������Ӧ����ת��ΪSO2(g)��SO3(g)����Ӧ���̺�������ϵ������ͼ��ʾ(ͼ�еĦ�H��ʾ����1 mol������������)��
(1)д����ʾS8ȼ���ȵ��Ȼ�ѧ����ʽ_____________________��
(2)д��SO3�ֽ�����SO2��O2���Ȼ�ѧ����ʽ_________________________��
(3)����֪SO2���������ļ���Ϊd kJ��mol-1��O2���������ļ���Ϊe kJ��mol-1����S8������������ļ���Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
(8��)(1)��(N2H4)�Ƿ��亽��ɴ����õĸ���ȼ�ϡ���NH3��NaClO��һ�����ʵ����Ȼ�Ϸ�Ӧ�������¡�NaCl��ˮ���÷�Ӧ�Ļ�ѧ����ʽ��_____________________________��
(2)�ڻ���ƽ�����װ��ǿ��ԭ����(N2H4)��ǿ�������������⣬�����ǻ��ʱ���������������壬���ų������ȡ���֪��H2O(l)H2O(g) ��H=" +44" kJ/mol��12.8 gҺ̬���������������ⷴӦ���ɵ�����ˮ�������ų�256.65 kJ��������
����д��Һ̬����������ⷴӦ����Һ̬ˮ���Ȼ�ѧ����ʽ______________________��
����16 gҺ̬���������������ⷴӦ����Һ̬ˮʱ�ų���������___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��֪��Ӧ��3I��(aq)+S2O82��(aq)  I3��(aq)+2SO42��(aq)+Q
I3��(aq)+2SO42��(aq)+Q
��1��д����Ӧ��ƽ�ⳣ������ʽ��K= ��
��2����ͼ��ʾ��Ӧ�������й����ʵ���������Ӧ�����е�Q 0����>��<��=������I������II���������У�ʹ�ô������� ���ߡ�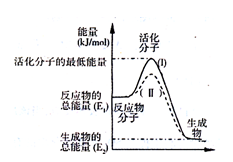
��3����Ӧ�����ʿ�����I3�������ĵ�����Һ��Ӧ����ɫ��ʱ��t��������tԽС����Ӧ����Խ���±�����20�����ʵ��ʱ����¼������
| ʵ���� | �� | �� | �� | �� | �� |
| c(I��)/mol��L��1 | 0��040 | 0��080 | 0��080 | 0��160 | 0��160 |
| c(S2O82��)/mol��L��1 | 0��040 | 0��040 | 0��080 | 0��080 | 0��040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com