
| A. | 12 g14C中含有的中子数是8NA | |
| B. | 28g氮气含有的原子数是2NA | |
| C. | 1mol铁与足量稀硝酸完全反应,失去的电子数3NA | |
| D. | 标准状况下,4.48 L NO和2.24 L O2混合气体中含分子总数为0.3NA |
分析 A.1个14C含有中子数为8个;
B.氮气为双原子分子,28g氮气的物质的量为1mol,含由2mol氮原子;
C.铁遇足量强氧化剂硝酸被氧化为三价铁;
D.NO和O2反应生成二氧化氮,分子数目减小.
解答 解:A.1个14C含有中子数为8个,则12 g14C中含有的中子数为$\frac{12}{14}×8$=$\frac{48}{7}$mol,即$\frac{48}{7}$NA,故A错误;
B.28g氮气的物质的量为$\frac{28g}{28g/mol}$=1mol,1mol氮气含有2mol氮原子,含有的原子数是2NA,故B正确;
C.1mol铁与足量的稀硝酸反应生成三价铁,失去电子数为1mol×3=3mol,即3NA,故C正确;
D.标准状况下,4.48 L NO的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,2.24 L O2的物质的量为$\frac{2.24L}{22.4L/mol}$=0.1mol,由于NO和O2反应生成二氧化氮,分子数目减小,故混合气体中含分子总数小于0.3NA,故D错误;
故选BC.
点评 本题考查阿伏伽德罗常数的分析应用,难度中等.要注意铁与足量的稀硝酸反应生成三价铁.


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 淀粉、纤维素、蛋白质的水解产物相同,都可以用来酿酒 | |
| B. | 油脂水解产物之一的甘油与乙醇含有相同的官能团 | |
| C. | 乙醇与乙醛互为同分异构体,乙醇可由乙烯通过加成反应制取 | |
| D. | 通过石油的裂化可得到乙烯,煤的干馏可得到煤焦油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2,3,3-四甲基丁烷 | B. | 2,3,4-三甲基戊烷 | ||
| C. | 3,4-二甲基己烷 | D. | 2,5-二甲基己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入10mL 0.01mol•L-1的NaOH溶液 | B. | 加入10mL 0.01mol•L-1的盐酸溶液 | ||
| C. | 加水稀释成100mL | D. | 加入10mL 的水进行稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | Al | B | Be | C | Cl | F | Li |
| 电负性 | 1.61 | 2.04 | 1.57 | 2.55 | 3.16 | 3.98 | 0.98 |
| 元素 | Mg | N | Na | O | P | S | Si |
| 电负性 | 1.31 | 3.04 | 0.93 | 3.44 | 2.19 | 2.58 | 1.90 |
| 锂 | X | Y | |
| 失去第1个电子 | 519 | 502 | 580 |
| 失去第2个电子 | 7296 | 4570 | 1820 |
| 失去第3个电子 | 11799 | 6920 | 2750 |
| 失去第4个电子 | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,同浓度的一元酸HA比HB易电离,则相同浓度的NaA溶液比NaB溶液的pH大 | |
| B. | 0.2mol/L,NH4NO3和0.1mol/L NaOH溶液等体积混合后:c(NH4+)>c(NO3-)>c(Na+)>c(OH-)>c(H+) | |
| C. | 物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c(Na+)+c(H+)=c(CH3COO-)+c(OH-)+c(CH3COOH) | |
| D. | 同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3•H2O ④CH3COONH4,其中c(NH4+)由大到小的是:①>②>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
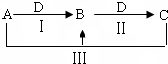 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如下(部分反应中的水已略去).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com