
ЁОЬтФПЁПФГЮТЖШЯТЃЌдкШнЛ§ЮЊ2LЕФКуШнУмБеШнЦїжаЃЌГфШы8 mol AКЭ4 mol BНјааШчЯТЗДгІЃК3A(g)+2B(g) ![]() 4C(s)+D(g)ЃЌ2 minДяЦНКтЃЌВтЕУЩњГЩ3.2mol CЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
4C(s)+D(g)ЃЌ2 minДяЦНКтЃЌВтЕУЩњГЩ3.2mol CЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.ЧА2 minЃЌDЕФЦНОљЗДгІЫйТЪЮЊ0.4 molЁЄLЃ1ЁЄminЃ1
B.BЕФЦНКтзЊЛЏТЪЪЧ40ЃЅ
C.ЦфЫћЬѕМўВЛБфЃЌдіДѓИУЬхЯЕЕФбЙЧПЃЌЦНКтВЛвЦЖЏ
D.ЦфЫћЬѕМўВЛБфЃЌЯђЦНКтЬхЯЕжаГфШыBЃЌЦНКтЯђгввЦЖЏЃЌBЕФЦНКтзЊЛЏТЪдіДѓ
ЁОД№АИЁПB
ЁОНтЮіЁП
2LЕФУмБеШнЦїжаЃЌМгШы8molAКЭ4molBНјааШчЯТЗДгІЃК3A(g)+2B(g)4C(s)+2D(g)ЃЌЗДгІвЛЖЮЪБМфКѓДяЕНЦНКтЃЌВтЕУЩњГЩ3.2mol CЃЌдђ
3A(g)+2B(g)4C(s)+D(g)
ПЊЪМЃЈmolЃЉ8 4 0 0
зЊЛЏЃЈmolЃЉ2.4 1.6 3.2 0.8
ЦНКтЃЈmolЃЉ5.6 2.4 3.2 0.8
A. ІдЃЈDЃЉ= =0.2 molL1min1ЃЌЙЪAДэЮѓЃЛ
=0.2 molL1min1ЃЌЙЪAДэЮѓЃЛ
B. ДяЕНЦНКтЃЌВЮМгЗДгІЕФBЕФЮяжЪЕФСПЮЊ1.6molЃЌЙЪBЕФзЊЛЏТЪЮЊ![]() ЁС100%=40%ЃЌЙЪBе§ШЗЃЛ
ЁС100%=40%ЃЌЙЪBе§ШЗЃЛ
C. ИУЗДгІе§ЗДгІЮЊЦјЬхЬхЛ§МѕаЁЕФЗДгІЃЌдіДѓбЙЧПЦНКтЯђе§ЗДгІвЦЖЏЃЌМДЯђгввЦЖЏЃЌЙЪCДэЮѓЃЛ
D. ЯђЦНКтЬхЯЕжаГфШыB ЃЌBЕФХЈЖШдіДѓЃЌЦНКтЯђе§ЗДгІвЦЖЏЃЌAЕФзЊЛЏТЪдіДѓЃЌBЕФзЊЛЏТЪНЕЕЭЃЌЙЪDДэЮѓЃЛ
Д№АИбЁBЁЃ


 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПAЁЂBЁЂCЁЂDЁЂEЖМЮЊЖЬжмЦкдЊЫиЃЌAЪЧЯрЖддзгжЪСПзюаЁЕФдЊЫиЃЛBЕФ+1МлбєРызгКЭCЕФЉ1МлвѕРызгЖМгыФЪдзгОпгаЯрЭЌЕФЕчзгВуНсЙЙЃЛDдкCЕФЯТвЛжмЦкЃЌПЩгыBаЮГЩBDаЭРызгЛЏКЯЮяЃЛEКЭCЮЊЭЌвЛжмЦкдЊЫиЃЌЦфзюИпМлбѕЛЏЮяЖдгІЕФЫЎЛЏЮяЮЊвЛжжЧПЫсЁЃЧыИљОнвдЩЯаХЯЂЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉBдЊЫидкдЊЫижмЦкБэжаЕФЮЛжУЪЧЕк______жмЦк______зхЃЛ
ЃЈ2ЃЉЛГіCдЊЫиЕФдзгНсЙЙЪОвтЭМ______ЃЛ
ЃЈ3ЃЉгыEЕФЧтЛЏЮяЗжзгЫљКЌЕчзгзмЪ§ЯрЕШЕФЗжзгЪЧ______ЃЈОйвЛР§ЃЌЬюЛЏбЇЪНЃЌЯТЭЌЃЉЁЂбєРызгЪЧ______ЃЛ
ЃЈ4ЃЉAгыDаЮГЩЕФЛЏКЯЮяжаКЌгаЛЏбЇМќЕФРраЭЪЧ_____ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
A.![]() БэЪОжазгЪ§ЮЊ10ЕФбѕдЊЫиЕФвЛжжКЫЫи
БэЪОжазгЪ§ЮЊ10ЕФбѕдЊЫиЕФвЛжжКЫЫи
B.Н№ИеЪЏКЭЪЏФЋЛЅЮЊЭЌЫивьаЮЬхЃЌСНепжЎМфВЛФмЯрЛЅзЊЛЏ
C.CH3COOHКЭCH3COOCH3ЛЅЮЊЭЌЯЕЮя
D.C6H14ЕФЭЌЗжвьЙЙЬхга4жжЃЌЦфШлЕуИїВЛЯрЭЌ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП[ЛЏбЇЁЊбЁао3ЃКЮяжЪНсЙЙгыаджЪ] ЛЏбЇзїЮЊвЛУХЛљДЁздШЛПЦбЇЃЌдкВФСЯПЦбЇЁЂЩњУќПЦбЇЁЂФмдДПЦбЇЕШжюЖрСьгђЗЂЛгзХживЊзїгУЁЃ
ЃЈ1ЃЉИпЮТГЌЕМВФСЯюЦБЕЭбѕЕФЛЏбЇЪНЮЊYBaCu3O7ЃЌЦфжа1/3ЕФCuвдКБМћЕФCu3+аЮЪНДцдкЁЃCuдкдЊЫижмЦкБэжаЕФЮЛжУЮЊ_______ЃЌЛљЬЌCu3+ЕФКЫЭтЕчзгХХВМЪНЮЊ____________ЁЃ
ЃЈ2ЃЉДХадВФСЯдкЩњЛюКЭПЦбЇММЪѕжагІгУЙуЗКЁЃбаОПБэУїЃЌШєЙЙГЩЛЏКЯЮяЕФбєРызггаЮДГЩЖдЕчзгЪБЃЌдђИУЛЏКЯЮяОпгаДХадЁЃЯТСаЮяжЪЪЪКЯзїТМвєДХДјДХЗлдСЯЕФЮЊ____ЃЈЬюбЁЯюзжФИЃЉЁЃ
AЃЎV2O5 BЃЎCrO2 CЃЎPbO DЃЎZnO
ЃЈ3ЃЉЭРпЯпЯвђдкПЙХБвЉЁЊЁЊЧрняЫибаОПжаЕФНмГіЙБЯзЃЌГЩЮЊЪзЛёПЦбЇРрХЕБДЖћНБЕФжаЙњШЫЁЃЧрняЫиЕФНсЙЙМђЪНШчЭМlЫљЪОЃЌЦфзщГЩдЊЫиЕФЕчИКадгЩДѓЕНаЁЕФЫГађЮЊ___________ЃЛЬМдзгЕФдгЛЏЗНЪНга_______ЁЃ
ЃЈ4ЃЉЁАПЩШМБљЁБвђДЂСПДѓЁЂЮлШОаЁБЛЪгЮЊЮДРДЪЏгЭЕФЬцДњФмдДЃЌгЩМзЭщКЭЫЎаЮГЩЕФЁАПЩШМБљЁБНсЙЙШчЭМ2ЫљЪОЁЃ
ЂйЁАПЩШМБљЁБжаЗжзгМфДцдкЕФ2жжзїгУСІЮЊ________________ЁЃ
ЂкH2OЕФVSEPRФЃаЭЮЊ___________ЃЌБШНЯМќНЧЕФДѓаЁЃКH2O_______CH4ЃЈЬюЁА>ЁБЁА<ЁБЛђЁА=ЁБЃЉЃЌдвђЮЊ___________________________________ЁЃ

ЃЈ5ЃЉяЎРызгЕчГидкБуаЏЪНЕчзгЩшБИвдМАЕчЖЏЦћГЕЁЂЮРаЧЕШСьгђЯдЪОГіЙуРЋЕФгІгУЧАОАЃЌИУЕчГиИКМЋВФСЯЮЊЪЏФЋЃЌЪЏФЋЮЊВузДНсЙЙЃЈШчЭМ3ЃЉЃЌЦфОЇАћНсЙЙШчЭМ4ЫљЪОЃЌИУОЇАћжага__________ИіЬМдзгЁЃвбжЊЪЏФЋЕФВуМфОрЮЊapmЃЌC-CМќГЄЮЊb pmЃЌАЂЗќйЄЕТТоГЃЪ§ЕФжЕЮЊNAЃЌдђЪЏФЋОЇЬхЕФУмЖШЮЊ_________________gЁЄcm-3ЃЈСаГіМЦЫуЪНЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШѕЕчНтжЪгааэЖрШчЃКДзЫсЁЂЬМЫсЁЂЧтЧшЫсЁЂвЛЫЎКЯАБЕШЃЌвбжЊ25ЁцЪБЃЌДзЫсЁЂЬМЫсЁЂЧтЧшЫсЕФЕчРыЦНКтГЃЪ§ШчЯТБэ
ЧтЧшЫс | ЬМЫс | ДзЫс |
Ka=6.2ЁС10-10 | Ka1=4.2ЁС10-7 Ka2=5.6ЁС10-11 | Ka=1.7ЁС10-5 |
ЃЈ1ЃЉ25ЁцЪБЃЌpHЯрЕШЕФШ§жжШмвКЂйCH3COONaШмвКЁЂЂкNa2CO3ШмвКЁЂЂлNaCNШмвКЃЌХЈЖШгЩДѓЕНаЁЕФЫГађЮЊ____(ЬюађКХ)ЁЃ
ЃЈ2ЃЉ25ЁцЪБЃЌЯђNaCNШмвКжаЭЈШыЩйСПCO2ЃЌЗДгІЕФРызгЗНГЬЪНЮЊ_________ЁЃ
ЃЈ3ЃЉНЋХЈЖШЮЊ0.02mol/LЕФHCN гы0.01mol/LNaOH ШмвКЕШЬхЛ§ЛьКЯЃЌдђЛьКЯШмвКжаc(H+) _____c(OH-)ЃЈгУ < > = ЬюПеЃЉ
ЃЈ4ЃЉГЃЮТЯТЃЌЯђХЈЖШЮЊ0.1 molЁЄLЃ1ЁЂЬхЛ§ЮЊV LЕФАБЫЎжаж№ЕЮМгШывЛЖЈХЈЖШЕФбЮЫсЃЌгУpHМЦВтШмвКЕФpHЫцбЮЫсЕФМгШыСПЖјНЕЕЭЕФЕЮЖЈЧњЯпЃЌdЕуСНжжШмвКЧЁКУЭъШЋЗДгІЁЃИљОнЭМжааХЯЂЛиД№ЯТСаЮЪЬтЃК
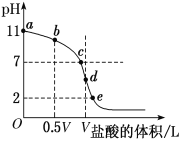
ЂйИУЮТЖШЪБNH3ЁЄH2OЕФЕчРыГЃЪ§KЃН______ЁЃ
ЂкБШНЯbЁЂcЁЂdШ§ЕуЪБЕФШмвКжаЃЌгЩЫЎЕчРыГіЕФc(HЃЋ)гЩДѓЕНаЁЫГађЮЊ________ЁЃ
ЂлЕЮЖЈЪБЃЌгЩbЕуЕНcЕуЕФЙ§ГЬжаЃЌЯТСаИїбЁЯюжаЪ§жЕБЃГжВЛБфЕФЪЧ________(ЬюзжФИЃЌЯТЭЌ)ЁЃ
AЃЎc(HЃЋ)ЁЄc(OH-) B. ![]()
C. 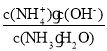 D.
D. ![]()
ЂмИљОнвдЩЯЕЮЖЈЧњЯпХаЖЯЯТСаЫЕЗЈе§ШЗЕФЪЧ________(ШмвКжаNдЊЫижЛДцдкNH![]() КЭNH3ЁЄH2OСНжжаЮЪН)ЁЃ
КЭNH3ЁЄH2OСНжжаЮЪН)ЁЃ
AЃЎЕуbЫљЪОШмвКжаЃКc(NH![]() )ЃЋc(HЃЋ)ЃНc(OHЃ)ЃЋc(NH3ЁЄH2O)
)ЃЋc(HЃЋ)ЃНc(OHЃ)ЃЋc(NH3ЁЄH2O)
BЃЎЕуcЫљЪОШмвКжаЃКc(ClЃ)ЃНc(NH3ЁЄH2O)ЃЋc(NH![]() )
)
CЃЎЕуdЫљЪОШмвКжаЃКc(ClЃ)>c(HЃЋ)>c(NH![]() )>c(OHЃ)
)>c(OHЃ)
DЃЎЕЮЖЈЙ§ГЬжаПЩФмгаЃКc(NH3ЁЄH2O)>c(NH![]() )>c(OHЃ)>c(ClЃ)>c(HЃЋ)
)>c(OHЃ)>c(ClЃ)>c(HЃЋ)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПШтЙ№ЫсмаѕЅгжУћБНБћЯЉЫсмаѕЅЃЌГЃзїЮЊЖЈЯуМСЃЌПЩгУгкЯудэМАЪГЦЗЯуОЋЕФЕїЯудСЯЁЃвдЯТЪЧвЛжжКЯГЩШтЙ№ЫсмаѕЅЕФТЗЯпЁЃ

вбжЊЃКIЃЎЯрЭЌЬѕМўЯТЃЌЬўAЖдЧтЦјЕФЯрЖдУмЖШЮЊ13
ЂђЃЎЗДгІЂйЁЂЗДгІЂкЕФдзгРћгУТЪОљЮЊ100%
IIIЃЎ
![]()

ЛиД№ЯТСаЮЪЬтЃК
(1)AЕФНсЙЙМђЪНЮЊ________ЃЌGжаЕФЙйФмЭХЕФУћГЦЪЧ____________ЁЃ
(2)ЗДгІЂлЕФЬѕМўЮЊ_______ЁЃЩЯЪіКЯГЩТЗЯпЂйЁЋЂпВНЩцМАЕФЗДгІжаЃЌЪєгкШЁДњЗДгІЕФга__________(ЬюБрКХ)ЁЃ
(3)аДГіЗДгІDЁњEЕФЛЏбЇЗНГЬЪН___________________________ЁЃ
(4)FЭЌЪБТњзуЯТСаЬѕМўЕФЭЌЗжвьЙЙЬхЙВга_________жж(ВЛПМТЧСЂЬхвьЙЙ)ЁЃ
ЂйБНЛЗЩЯга2ИіШЁДњЛљ
ЂкФмЗЂЩњвјОЕЗДгІКЭЫЎНтЗДгІ
ЂлФмгыFeCl3ШмвКЗЂЩњЯдЩЋЗДгІ
ЦфжаКЫДХЙВеёЧтЦзЯдЪО6зщЗхЃЌЧвЗхУцЛ§БШЮЊ3 :2: 2:1:1:1ЕФЪЧ___________(ЬюНсЙЙМђЪН)ЁЃ
(5)ВЮееЩЯЪіКЯГЩТЗЯпЃЌвдCH3CHOЮЊдСЯЃЌЩшМЦжЦБИ![]() ЕФКЯГЩЯпТЗ(ЮоЛњЪдМСМАШмМСШЮбЁ)_____________________________ЁЃ
ЕФКЯГЩЯпТЗ(ЮоЛњЪдМСМАШмМСШЮбЁ)_____________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПФГУмБеШнЦїжаЗЂЩњШчЯТЗДгІЃКXЃЈgЃЉ+3YЃЈgЃЉ2ZЃЈgЃЉЃЛЁїHЃМ0ЃЎЩЯЭМБэЪОИУЗДгІЕФЫйТЪЃЈvЃЉЫцЪБМф
ЃЈtЃЉБфЛЏЕФЙиЯЕЃЌt2ЁЂt3ЁЂt5ЪБПЬЭтНчЬѕМўгаЫљИФБфЃЌЕЋЖМУЛгаИФБфИїЮяжЪЕФГѕЪММгШыСПЁЃЯТСаЫЕЗЈжаВЛе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ

A. ![]() ЪБМгШыСЫДпЛЏМСB.
ЪБМгШыСЫДпЛЏМСB. ![]() ЪБНЕЕЭСЫЮТЖШ
ЪБНЕЕЭСЫЮТЖШ
C. ![]() ЪБдіДѓСЫбЙЧПD.
ЪБдіДѓСЫбЙЧПD. ![]() ЪБМфФкзЊЛЏТЪзюИп
ЪБМфФкзЊЛЏТЪзюИп
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЫЕЗЈе§ШЗЕФЪЧ
A.ЫЎЪЧШѕЕчНтжЪЃЌЕчРыЗНГЬЪНЮЊH2O+H2O![]() H3OЃЋ+OHЃ
H3OЃЋ+OHЃ
B.ГЃЮТЯТЃЌЯђЫЎжаМгШыH2SO4ШмвКЃЌHЃЋ ХЈЖШдіДѓЃЌKwдіДѓ
C.НЋДПЫЎМгШШЕН100ЁцЃЌpHЁж6ЃЌЯдЫсад
D.ГЃЮТЯТЃЌНЋ0.1molЁЄLЃ1ЕФ NaOHШмвКЬхЛ§ЯЁЪЭЕНдРДЕФ10БЖЃЌдђpHЃН12
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвбжЊ AЁЂBЁЂCЁЂDЁЂE ЮхжжжїзхдЊЫиЗжЪєШ§ИіЖЬжмЦкЃЌЧвдзгађЪ§вРДЮдіДѓЁЃAЁЂC ЭЌжїзхЃЌПЩаЮГЩРызгЛЏКЯЮя CAЃЛBЁЂD ЭЌжїзхЃЌПЩаЮГЩ DB2ЁЂDB3 СНжжЗжзгЁЃЧыЛиД№ЯТСаЮЪЬтЃК
(1)ЮхжждЊЫидзгАыОЖгЩаЁЕНДѓЕФЫГађЮЊ_______________ЃЈгУдЊЫиЗћКХЛиД№ЃЉЁЃ
(2)AЁЂB СНжждЊЫиФмаЮГЩМШКЌМЋадМќгжКЌЗЧМЋадМќЕФЛЏКЯЮя MЃЌM ЕФЕчзгЪНЮЊ_______________ЁЃ
(3)ЗЧН№ЪєадЧПШѕЃКD_______________EЃЈЬюЁА>ЁБЁА<ЁБЃЉЃЌгУРызгЗНГЬЪНБэЪО__________________________ЁЃ
(4)аДГіОљгЩ AЁЂBЁЂCЁЂD ЫФжждЊЫизщГЩЕФСНЮяжЪЕФХЈШмвКЗЂЩњЗДгІЕФРызгЗНГЬЪН_____________________________ЁЃ
ВщПДД№АИКЭНтЮі>>
АйЖШжТаХ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com