
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| n��n |
| (1-n)��(1-n) |
| 0.5mol |
| 1mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015�츣��ʡ����У�߶���ѧ�����п��Ի�ѧ�Ծ��������棩 ���ͣ������
Ϊ�˼���CO�Դ�������Ⱦ��ij�о���ѧϰС�����о�CO��H2O��Ӧת��Ϊ��ɫ��ԴH2����֪��
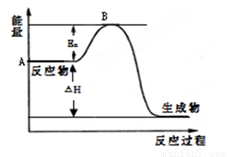
2CO(g)+O2(g)��2CO2(g) ��H =��566 kJ��moL��1
2H2(g)+O2(g)��2H2O(g) ��H =��483.6 kJ��moL��1
H2O(g)��H2O(l) ��H =��44.0 kJ��moL��1
��1�������ı�ȼ���ȡ�H = kJ��moL��1��
��2��д��CO��H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ�� ��
��3��H2��һ���������ɫ��Դ������ȼ�ϵ�أ���������ȼ�ϵ����KOHΪ�������Һ���为���ĵ缫��Ӧʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014���Ĵ�ʡ�Ű��и߶���ѧ����ĩ��⻯ѧ�Ծ��������棩 ���ͣ������
Ϊ�˼���CO�Դ�������Ⱦ��ij�о���ѧϰС�����о�CO��H2O��Ӧת��Ϊ��ɫ��ԴH2����֪��
2CO(g)+O2(g)��2CO2(g) ��H����566kJ��moL��1
2H2(g)+O2(g)��2H2O(g) ��H����483.6KJ��moL��1
H2O (g)��H2O(l) ��H����44.0KJ��moL��1
��1�������ı�ȼ���ȡ�H�� kJ��moL��1
��2��д��CO��H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ
��3���� 1L�������������м���1.00mol CO��1.00mol H2O(g)����t��ʱ��Ӧ���ﵽƽ�⣬���÷�Ӧ�Ļ�ѧƽ�ⳣ��K��1����t��ʱCO ��ת����Ϊ ����Ӧ�ﵽƽ��������¶ȣ���ʱƽ�ⳣ���� �����������䡱��С������ƽ�⽫�� ����������桱�������ƶ���
��4����CO��H2O��Ӧת��Ϊ��ɫ��ԴH2�У�Ϊ�����CO��ת���ʣ��ɲ�ȡ�Ĵ�ʩ�� ��
A�������COŨ�� B�������H2O(g)Ũ�� C��ʹ�ô��� D�������¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�츣��ʡ��ѧ�ڸ߶���ĩ���Ի�ѧ�Ծ� ���ͣ������
��10�֣�Ϊ�˼���CO�Դ�������Ⱦ��ij�о���ѧϰС�����о�CO��H2O��Ӧת��Ϊ��ɫ��ԴH2����֪��2CO(g)+O2(g)==2CO2(g) ��H=��566KJ/mol
2H2(g)+O2(g)==2H2O(g) ��H=��483.6KJ/mol H2O(g)== H2O(l) ��H=��44.0KJ/mol
(1)1mol����ȼ������Һ̬ˮʱ�ų�����Ϊ____________
(2)д��CO�� H2O(g)��������CO2��H2���Ȼ�ѧ����ʽ_________________________��
(3)��1L�������������м���0.200molCO��1.00molH2O(g)����t��ʱ��Ӧ���ﵽƽ�⣬���÷�Ӧ�Ļ�ѧƽ�ⳣ��K=1����t��ʱCO��ת����Ϊ___________����Ӧ�ﵽƽ��������¶ȣ���ʱƽ�ⳣ����___________����������С�����䡱����ƽ�⽫��__________����������桱����Ӧ�����ƶ���
(4)H2��һ���������ɫ��Դ������ȼ�ϵ�أ���������ȼ�ϵ����KOHΪ�������Һ���为���ĵ缫��Ӧʽ��_______________________________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com