
| A. | 无色溶液中:NH4+、Cu2+、CO32-、Cl- | |
| B. | 中性溶液中可能大量存在Na+、Ba2+、Cl-、NO3- | |
| C. | pH值为1的溶液:Na+、Al3+、CH3COO-、SO42- | |
| D. | 由水电离的c(H+)=1×10-13mol•L-1的溶液中:Mg2+、K+、HCO3-、Br- |
分析 A.无色溶液中不会存在铜离子,铜离子与碳酸根离子反应;
B.四种离子之间不发生反应,能够存在于中性溶液中;
C.pH=1的溶液中存在大量氢离子,醋酸根离子与氢离子反应;
D.由水电离的c(H+)=1×10-13mol•L-1的溶液中存在大量氢离子或氢氧根离子,
解答 解:A.Cu2+为有色离子,且Cu2+、CO32-之间发生反应,在溶液中不能大量共存,故A错误;
B.Na+、Ba2+、Cl-、NO3-之间不发生反应,能够在中性溶液中大量共存,故B正确;
C.pH为1的溶液为酸性溶液,CH3COO-与酸性溶液中的氢离子反应,在溶液中不能大量共存,故C错误;
D.由水电离的c(H+)=1×10-13mol•L-1的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,HCO3-与氢离子和氢氧根离子反应,在溶液中一定不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:解答题
| 溶液 | 加入的物质 | 答案序号 |
| AlCl3溶液 | 通入过量的NH3 | ① |
| 含少量NaOH的NaAlO2溶液 | 通过量的CO2 | ② |
| NaAlO2溶液 | 滴加稀H2SO4至过量 | ③ |
| MgCl2和AlCl3的混合液 | 滴加NaOH溶液至过量 | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 电解质溶液 | 阳极 | 阴极 | 加入的物质 | |
| A | NaCl溶液 | 碳 | 铁 | 盐酸 |
| B | 稀硫酸 | 铜 | 碳 | 水 |
| C | 硫酸铜溶液 | 铜 | 碳 | 硫酸铜 |
| D | NaOH溶液 | 碳 | 铁 | 水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
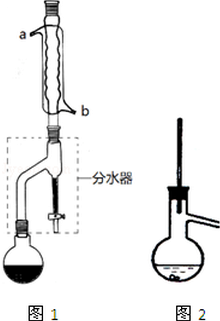 有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:
有机物的反应往往伴随副反应发生,因此需要分离提纯.有一种水果香精的合成步骤如下:| 化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
| 密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
| 沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
| 在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜时,粗铜作阴极 | |
| B. | 电解精炼铜时,溶液浓度基本不变 | |
| C. | 在铁制容器上镀铜时,可用CuSO4溶液作电镀液 | |
| D. | 在铁制容器上镀铜时,铁制容器连接外接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
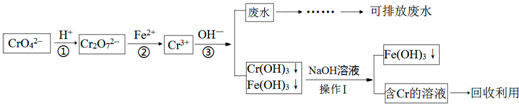
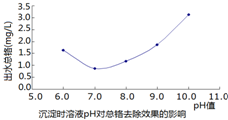
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量8.70g食盐 | |
| B. | 用广泛pH试纸测定氯水的pH值为3.5 | |
| C. | 在蒸发皿中灼烧氢氧化铁获得铁红 | |
| D. | 用加热的方法分离氯化钠和氯化铵的固体混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数目相等的三种气体,质量最大的是Z | |
| B. | 相同条件下,同质量的三种气体,气体密度最小的是X | |
| C. | 若一定条件下,三种气体体积均为2.24L,则它们的物质的量一定均为0.1mol | |
| D. | 同温下,体积相同的两容器分别充2gY气体和1gZ气体,则其压强比为2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com