


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
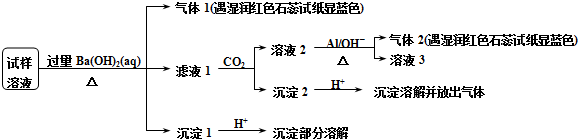
| △ |
| A、试样中肯定存在NH4+、Mg2+、SO42-和NO3- |
| B、试样中可能存在Na+、Cl- |
| C、试样中一定不含Al3+ |
| D、可以确定该雾霾的成分是NaNO3、NH4Cl和MgSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成纤维与人造纤维可以统称为化学纤维 |
| B、酚醛树脂和聚氯乙烯都是热固性塑料 |
| C、天然橡胶的化学组成是聚异戊二烯 |
| D、复合材料一般有强度高、质量轻、耐高温、耐腐蚀等优异性能,其综合性质超过了单一材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、比较碳、硫非金属性:在相同条件下测定相同物质的量浓度的Na2CO3、Na2SO4溶液的pH |
| B、比较Cu、Fe的还原性:单质铜加入硫酸铁溶液中 |
| C、比较溴单质、碘单质的氧化性:碘化钠溶液中加入液溴 |
| D、比较钠、钾的金属性:钠、钾分别放入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、①⑤⑥ |
| C、①②④ | D、③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com