
分析 (1)Na元素的化合价升高,H元素的化合价降低,转移的电子数为2e-;
(2)MnO2+4HCl(浓)═MnCl2+Cl2↑+2H2O中Mn元素化合价降低,被还原,MnO2为氧化剂,Cl元素化合价升高,被氧化,HCl为还原剂,转移电子数为2e-.
解答 解:(1)2Na+2H2O=2NaOH+H2↑中,H元素的化合价降低,H2O为氧化剂,Na为还原剂,转移的电子数为2e-,则双线桥表示电子转移方向及数目为 ,
,
故答案为:H2O;H2; ;
;
(2)MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合价降低,氧化剂为MnO2,MnCl2为还原产物,Cl元素的化合价升高,被氧化,HCl为还原剂,Cl2为氧化产物,则1mol氧化剂反应转移2mole-,用双线桥法表示反应中电子转移的数目为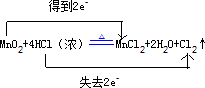 ,
,
故答案为:MnO2;HCl; .
.
点评 本题考查氧化还原反应中转移电子数目,把握元素化合价变化及双线桥法表示转移电子的方向和数目为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 使淀粉碘化钾试纸变蓝的溶液中:Cs+、Ba2+、S2-、Cl- | |
| B. | 1mol•L-1的烧碱溶液中:S2-、SO32-、K+、SO42- | |
| C. | 滴NH4SCN溶液显红色的溶液中:K+、Fe2+、SO42-、Cl- | |
| D. | 含有大量HCO3-的澄清透明溶液中:K+、NH4+、Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分液时,应先打开活塞放出下层液体,再关闭活塞倒出上层液体 | |
| B. | 将盛有体积比为2:1的NO和NO2混合气体的试管倒立在水中,溶液会充满试管 | |
| C. | 为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚内加热熔化 | |
| D. | 与水反应生成含氧酸的氧化物都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (10-8+10-10)/2 mol/L | B. | (10-8+10-10)mol/L | ||
| C. | (10-14-5×10-5)mol/L | D. | 2×10-10 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 10 | 10 | 4 | 4 |
| 溶液 | 氨水 | NaOH溶液 | 醋酸 | 盐酸 |
| A. | ③④中分别加入适量醋酸钠晶体,两溶液pH均增大 | |
| B. | ②③两溶液等体积混合,所得溶液中:c(H+)>c(OH-) | |
| C. | 分别加水稀释10倍,溶液的pH:①>②>④>③ | |
| D. | V1L④和V2L①溶液混合后,若pH=7,则V1<V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚能与3molH2加成得到环己醇 | |
| B. | 甲苯可以使酸性高锰酸钾溶液褪色 | |
| C. | 苯酚与浓溴水反应可得到2,4,6-三溴苯酚 | |
| D. | 苯酚能与NaOH溶液反应生成苯酚钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com