
【题目】已知Br2+2Fe2+===2Fe3++2Br-。向100mLFeBr2溶液中通入标况下氯气6.72L,氯气全部被还原,测得溶液c(Br-)=c(Cl-),原溶液中FeBr2溶液的浓度(mol·L-1)为( )
A. 2 B. 4 C. 2.5 D. 6
科目:高中化学 来源: 题型:
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,食品添加剂、感光剂等。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。回答下列问题:
(1)水合肼的制备
有关反应原理为:NaClO+2NH3=N2H4·H2O+NaCl。
①用下图装置制取水合肼,其连接顺序为_________(按气流方向,用小写字母表示)。
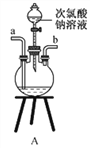
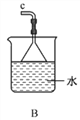
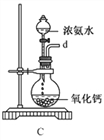

②装置C中发生反应的化学方程式为_____________________,装置D的作用是__________________。
(2)碘化钠的制备
步骤一:向三口烧瓶中加入8.2gNaOH及30mL水,搅拌冷却,加入25.4g单质碘,开动磁力搅拌器,保持60~70℃至反应充分;
步骤二:继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的某气体;
步耀三:向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
步骤四:将步骤三分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.3g。
①步骤一反应温度不宜超过70℃的原因是________________________;该步骤反应完全的现象是_______________________________。
②步骤二中IO-参与反应的离子方程式为_______________________________。
③步骤三“将溶液与活性炭分离”的方法是_____________________________。
④本次实验产率为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求回答下列有关问题。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________,温度升高后,K 值________(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=____________,温度升高后,K 值________(填“增大”、“不变”或“减小”)。
(2)已知:①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) H1= +489.0kJ/mol
②Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H2= -28.5kJ/mol
2Fe(s)+3CO2(g) H2= -28.5kJ/mol
③C(石墨)+ CO2(g) = 2CO(g) H3= akJ/mol ,
则a=__________kJ/mol。
(3)在T℃时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为_______。
②下列情况标志反应达到平衡状态的是________(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列设计的实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1molLFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5ml.0.1mo/L的KMnO4溶液,分别加入2mL0.1mol/L和10.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间 |
C | 证明海带中含有碘元素 | 将海带剪碎、加蒸馏水浸泡,取滤液加几滴稀硫酸和1mLH2O2,再加入几滴淀粉溶液,溶液变蓝 |
D | 验证CH3COONa 溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500 mL NH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含amol NaOH的溶液恰好完全反应;另取一份加入含b moI HC1的溶液恰好不再放出气体。则该混合溶液中c(Na+)为 ( )
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作。回答下列问题:

(1)试剂Ⅰ的化学式为_______。
(2)试剂Ⅱ的化学式为_______,②中加入试剂Ⅱ的目的是除去A中的____,检验该离子已经除尽的方法是________________________________________________________。
(3)③中发生反应的化学方程式为_________________________________________________。
(4)由E得到KCl晶体的实验操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,能大量共存的离子组是( )
A.Ba2+、Na+、SO42-、Cl-B.Fe2+,SO42-、NO3-、H+
C.OH-、HCO3-、Ca2+、Na+D.K+、Na+、OH-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算。
(1)含0.4 mol Al3+的Al2(SO4)3中所含的SO42-的物质的量是___________。
(2)___________molH2O2所含原子数与0.2molH3PO4所含原子数相等。
(3)某硫酸钠溶液中含有3.01×1022个Na+,则溶液中SO42-的物质的量是___________。
(4)0.7 mol H2O的质量为___________。
(5)483gNa2SO4·10H2O中所含的Na+的物质的量是___mol,所含H2O分子的数目是___个。
(6)质量相同的H2、NH3、SO2、O3四种气体中,含有分子数目最少的是____________。
(7)a个X原子的总质量为bg,则X的相对原子质量可以表示为___________
(8)现有mg某气体,它是三原子分子,其摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,请用以上符号及相应数字填写下列空格。
①该气体的物质的量为___________mol。
②该气体所含原子总数为___________个。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com