
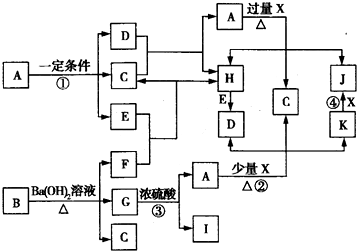
 ��FΪNH3�������ĵ���ʽΪ��
��FΪNH3�������ĵ���ʽΪ�� ����Ӧ����Ba��NO3��2+H2SO4��Ũ��=BaSO4��+2HNO3�����ڸ��ֽⷴӦ��
����Ӧ����Ba��NO3��2+H2SO4��Ũ��=BaSO4��+2HNO3�����ڸ��ֽⷴӦ�� ��
�� �����ֽⷴӦ��
�����ֽⷴӦ�� Fe3++3NO2��+3H2O����Ӧ����������������Ӧ�������������ķ�Ӧ����Ӧ�����ӷ���ʽΪ��2Fe3++Fe=3Fe2+��
Fe3++3NO2��+3H2O����Ӧ����������������Ӧ�������������ķ�Ӧ����Ӧ�����ӷ���ʽΪ��2Fe3++Fe=3Fe2+�� Fe3++3NO2��+3H2O��2Fe3++Fe=3Fe2+��
Fe3++3NO2��+3H2O��2Fe3++Fe=3Fe2+��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����


| ||
| ||


�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
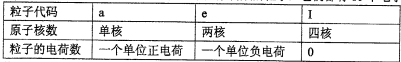
| ���Ӵ��� | a | e | I |
| ԭ�Ӻ��� | ���� | ���� | �ĺ� |
| ���ӵĵ���� | һ����λ����� | һ����λ����� | 0 |

| ||
| ||


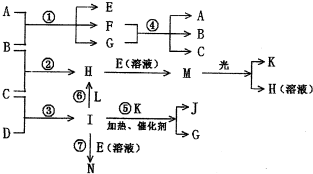
 �ĵ���ʽ
�ĵ���ʽ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014�켪��ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ������
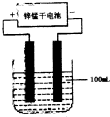
��13�֣���1�������£�0.05mol/L������Һ��,c(H+)= mol/L��pHֵΪ ��ˮ�����c(H+)= mol/L����ͼ��ʾ��һ���¶��£��������ˮϡ��������Һ�ĵ�����������ͼ����ش�

��2����O����Ϊʲô������ ��
��3��a��b��c�����������Ũ����С�����˳��Ϊ ��
��4��a��b��c�����У�����ĵ���̶�����һ���� ��
��5����ʹc����Һ�е�c(CH3COO��)��ߣ������´�ʩ�У���ѡ�� ��
A����NaCl��Һ B������
C���ӹ���KOH D����Zn��
E���ӹ���CH3COONa F����ˮ
��6����ϡ�����У����Ŵ���Ũ�ȵĽ��ͣ�����ʼ�ձ����������Ƶ�����__________________��
A.H������ B��c(H��)
C��c(H��)/c(CH3COOH) D��CH3COOH������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ���¿��� ���ͣ������
 N2O4(g) ��H ����56��9kJ/mol��
N2O4(g) ��H ����56��9kJ/mol��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com