
【题目】下图所示装置可用来制取Fe(OH)2和观察Fe(OH)2在空气中被氧化时的颜色变化。实验时必须使用铁屑、6 mol/L H2SO4溶液和NaOH溶液。填写下列空白:
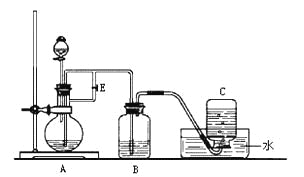
(1)B中盛有一定量的______________,A中应预先加入的试剂是_________,
A中反应的化学方程式为________________________________________。
(2)实验开始时应先将活塞E_______(填“打开”或“关闭”),目的是______________________________________________________________________________。
(3)A反应一段时间后将活塞E_______(填“打开”或“关闭”),目的是____________________________________________________________________________。
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化。若反应过程中转移了0.04mol电子,则参加反应的氧气的体积为____________L(标准状况)。
【答案】NaOH溶液 铁屑 Fe+H2SO4=FeSO4+H2↑ 打开 让生成的氢气排走装置和溶液中的空气 关闭 把A中FeSO4溶液压入B中反应 0.224
【解析】
制取Fe(OH)2的关键是防止氧气的氧化,预先排除装置中的空气,结合所给装置及药品,制取Fe(OH)2:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;而通过反应Fe+H2SO4=FeSO4+H2↑产生的氢气来排除装置中的空气;
(1)检验装置气密性后,在A烧瓶中放入铁屑,分液漏斗中装有稀硫酸,B中盛放NaOH溶液;
(2)实验开始时应先将活塞E打开,打开分液漏斗的活塞,产生氢气,让生成的氢气排走装置和溶液中的空气;
(3)A反应一段时间后将活塞E关闭,继续产生的氢气使烧瓶内压强增大,把A中FeSO4溶液压入B中反应,与其中的NaOH溶液反应生成白色Fe(OH)2沉淀;
(4)实验结束,拔去装置B中的橡皮塞,使空气进入,Fe(OH)2被氧化,沉淀颜色由白迅速置换为灰绿色,最终转变为红褐色,完成实验。由4Fe(OH)2+O2+2H2O=4Fe(OH)3可知,当反应过程中转移了0.04mol电子,则参加反应的氧气为0.01mol,标准状况下体积为0.224L。


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g) ![]() C(g)+D(g),已达到平衡状态的是( )
C(g)+D(g),已达到平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧B. ①③④⑤
C. ①②③④⑤⑦D. ①③④⑤⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧热是指在25℃,101kPa,1mol可燃物完全燃烧生成稳定的化合物时放出的热量。已知热化学方程式:①CO(g)+1/2 O2(g)=CO2(g) ΔH= -283.0kJ·mol-1
②H2(g)+1/2O2(g)=H2O(g) ΔH= -241.8kJ·mol-1
则下列说法正确的是
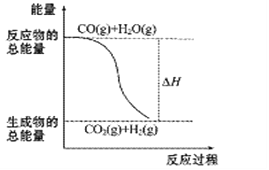
A. H2的燃烧热为241.8 kJ·mol-1
B. 由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH= -41.2kJ·mol-1
CO2(g)+H2(g) ΔH= -41.2kJ·mol-1
C. H2(g)转变成H2O(g)的化学反应一定要释放能量
D. 根据②推知反应H2(g)+1/2O2(g)=H2O(l) ΔH> -241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津大学某科研团队创新地提出了一种基于电化学冶金原理并利用电解质去耦合策略,在电池中同时进行MnO2和Zn可逆溶解/电沉积的储能机制,其工作原理如图,电池放电总反应为Zn+4OH-+MnO2+4H+![]() Zn(OH)
Zn(OH)![]() +Mn2++2H2O。下列说法不正确的是( )
+Mn2++2H2O。下列说法不正确的是( )
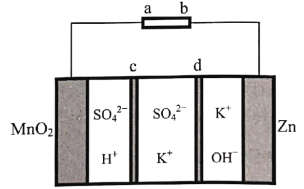
A.充电时,Zn电极区为阴极区
B.c为阴离子交换膜,d为阳离子交换膜
C.放电时,正极电极反应式为MnO2+4H++2e-=+Mn2++2H2O
D.充电时,电子的流向为a→MnO2→电解质溶液→Zn→b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式___。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8kJ/mol、-283.0kJ/mol和-726.5kJ/mol。请回答下列问题:
①用太阳能分解10mol水消耗的能量是___kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式_____;
③研究NO2、SO2、CO等大气污染气体的处理具有重要意义,已知:
2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ/mol
2NO(g)+O2(g)=2NO2(g) ΔH=-113.0kJ/mol
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的ΔH=___kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如图所示原电池的说法正确的是
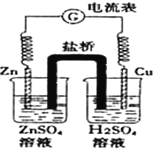
A. 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降
B. 盐桥的作用是让电子通过,以构成闭合回路
C. 随着反应进行,右烧杯中溶液pH变小
D. 总反应为:2H++ Zn ="==" H2↑+ Zn2+△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2mol钠和1mol铝的混合物小心地投入932g水中,充分反应,计算:
(1)生成气体的质量为多少______?
(2)溶液中有几种溶质______?
(3)各溶质的质量分数为多少______?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项叙述中不正确的是( )
A.小苏打是面包发酵粉的主要成分之一
B.侯氏制碱法的工艺过程中应用了物质溶解度的差异
C.用酚酞溶液可鉴别饱和食盐水和饱和纯碱溶液
D.NaHCO3的热稳定性大于Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com