
| A. | c(A-)<c(K+) | B. | c(H+)=c(OH-)<c(K+)<c(A-) | ||
| C. | V总≥20mL | D. | V总≤20mL |
分析 pH=10的KOH溶液,c(OH-)=0.0001mol/L,pH=4的一元酸HA溶液若强酸,c(H+)=c(HA)=0.0001mol/L,混合后pH=7,则等体积混合;
若酸为弱酸,c(HA)>0.0001mol/L,混合后pH=7时,应为醋酸和醋酸钾的混合溶液,其体积应小于10mL,以此来解答.
解答 解:pH=10的KOH溶液,c(OH-)=0.0001mol/L,pH=4的一元酸HA溶液若强酸,c(H+)=c(HA)=0.0001mol/L,混合后pH=7,则等体积混合;
若酸为弱酸,c(HA)>0.0001mol/L,混合后pH=7时,应为醋酸和醋酸钾的混合溶液,其体积应小于10mL,即V总≤20mL,
又pH=7,则c(OH-)=c(H+),由电荷守恒可知,c(H+)+c(K+)=c(OH-)+c(A-),则c(A-)=c(K+),
溶液中显性离子浓度大于隐性离子浓度,所以c(A-)=c(K+)>c(OH-)=c(H+),
故选D.
点评 本题考查酸碱混合溶液的计算,题目难度中等,明确酸的强弱及电荷守恒是解答本题的关键,注意酸为弱酸时浓度大,其体积应小于碱的体积才能满足混合溶液的pH=7,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑦ | B. | ①②③⑥ | C. | ①②⑥⑦ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:2 | B. | 3:1 | C. | 15:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Na2S | B. | CuSO4 | C. | NaCl | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
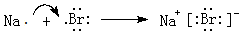 ,灼烧该化合物时,火焰呈黄 色.
,灼烧该化合物时,火焰呈黄 色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
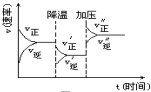 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 逆反应是放热反应 | B. | 正反应是放热反应 | ||
| C. | 若A、B是气体,则D一定是气体 | D. | A、B、C、D均为气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
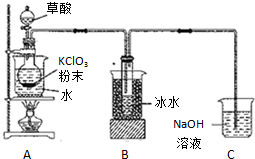 二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用KClO3粉末与草酸(H2C2O4)在60℃时反应可生成ClO2等物质,实验装置如图所示:
二氧化氯(ClO2)是一种高效消毒剂,沸点为11℃.用KClO3粉末与草酸(H2C2O4)在60℃时反应可生成ClO2等物质,实验装置如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com