
【题目】某种 “全氢电池”的工作原理如图所示。下列说法错误的是( )

A.右边吸附层中发生了氧化反应
B.负极的电极反应是H2-2e-+2OH-===2H2O
C.该电池总反应是H++OH-===H2O
D.电解质溶液中Na+向右移动、ClO4-向左移动
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.可通过加成反应实现![]() 的转化
的转化
B.组成元素的质量分数相同,相对分子质量也相同的不同化合物,一定互为同分异构体
C.核磁共振氢谱、红外光谱都能够快速精确地测定有机物的相对分子质量
D.烯烃只能发生加成反应,不能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关叙述正确的是
A. 0.1 mol·L1 Na2S溶液与0.1 mol·L1 NaHS溶液等体积混合:3c(Na+)2c(HS)=2c(S2)+2c(H2S)
B. 向20 mL 0.1 mol·L1 NH4HSO4溶液中滴入0.1 mol·L1 NaOH溶液 20 mL:2c(![]() )=c(NH3·H2O)+c(
)=c(NH3·H2O)+c(![]() )
)
C. 10 mL 0.1 mol·L1 CH3COONa溶液与6 mL 0.2 mol·L1盐酸混合:c(Cl)>c(Na+)>c(OH)>c(H+)
D. 0.2 mol·L1 NaHCO3溶液和0.1 mol·L1 NaOH溶液等体积混合:3c(![]() )+6c(H2CO3)c(Na+)=3c(OH)3c(H+)
)+6c(H2CO3)c(Na+)=3c(OH)3c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D在元素周期表中的位置如图所示,其中A所处的周期序数与主族序数相等。
B | D | |
A | C |
请回答下列问题:
(1)A在周期表中的位置是_____;D单质的电子式为_____。
(2)C、D的最简单氢化物中,稳定性较强的是_____(填化学式);C的最高价含氧酸是____(填“离子”或“共价”)化合物。
(3)A、D的简单离子的半径大小关系为:_____(用化学式填空);用一个反应可证明元素B、D的非金属性强弱关系,该反应的化学反应方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一种综合处理SO2废气的工艺流程,若每步都完全反应。下列说法正确的是 ( )

A.溶液B中发生的反应为2SO2+O2=2SO3
B.可用酸性高锰酸钾溶液检验溶液C中是否含有Fe3+
C.由以上流程可推知氧化性:Fe3+>O2>SO42—
D.此工艺的优点之一是物质能循环利用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:
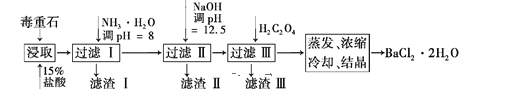
(1)毒重石用盐酸浸取前需充分研磨,目的是增大接触面积从而_____________。
(2) 加入NH3·H2O调节pH=8可除去____(填离子符号),此时,溶液中该离子的浓度为______mol·L-1。再加入NaOH调pH=12.5,溶液内剩余的阳离子中______完全沉淀,____部分沉淀 (填离子符号)。加入H2C2O4时应避免过量,原因是____。已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9, Ksp[Fe(OH)3] =2.6×10-39。

(3由于Na2S2O5具有毒性,因此国家对其在食品中的用量有严格的规定。某化学兴趣小组在测定某白葡萄酒中Na2S2O5的残留量时,取40mL葡萄酒样品于锥形瓶中,滴入几滴淀粉溶液,用0.02 mol·L-1碘的标准溶液滴定至终点,消耗碘标准溶液5mL,则滴定终点的现象为__________,Na2S2O5的含量是以SO2来计算的,则该样品中Na2S2O5的残留量以![]() 计为______
计为______![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加NaOH溶液,混合液中lgX随pH的变化关系如图所示。下列说法不正确的是( )
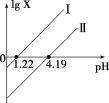
A.线Ⅰ中X表示的是![]()
B.线Ⅰ、Ⅱ的斜率均为1
C.c(HC2O42-) > c(C2O42-) > c(H2C2O4)对应溶液pH:1.22 < pH < 4.19
D.c(Na+)=c(HC2O4-)+2c(C2O42-)对应溶液的pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组以CoCl26H2O、过氧化氢、液氨、氯化铵固体为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验:

①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品溶液中的氨全部蒸出,用V1 mL c1 molL-1的盐酸溶液吸收。蒸氨结束后取下接收瓶,用c2 molL-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
②氯的测定:准确称取样品X配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现砖红色沉淀不在消失为终点(Ag2CrO4为砖红色)。 回答下列问题:
(1)装置中安全管的作用原理是___________________。
(2)用NaOH标准溶液滴定过剩的HCl时,一般选用的指示剂为___________。
(3)样品中氨的质量分数表达式为____________________。
(4)测定氯的过程中,使用棕色滴定管的原因是____________________。
(5)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为______。制备X的化学方程式为_____________。X的制备过程中温度不能过高的原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④![]() 的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥晶体根据结构和性质只可分为分子晶体、原子晶体、离子晶体和金属晶体四大类
⑦干冰晶体中,一个![]() 分子周围有12个
分子周围有12个![]() 分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
分子紧邻;CsCl和NaCl晶体中阴、阳离子的配位数都为6。
A.①②③⑥B.②③④C.④⑤⑥D.②③⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com