
| A. | pH>7,且 c(OH-)>c(Na+)>c(H+)>c(CH3COO-) | B. | pH>7,且 c(Na+)+c(H+)=c(OH-)+c(CH3COO-) | ||
| C. | pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | D. | pH=7,且c(CH3COO-)=c(Na+) |
分析 A.氢离子和氢氧根离子反应生成水,钠离子不参加反应,则:c(Na+)>c(OH-);
B.任何电解质溶液都存在电荷守恒;
C.常温下,pH<7,则氢离子浓度大于氢氧根离子;
D.常温下pH=7,说明溶液呈中性,根据电荷守恒判断.
解答 解:A.氢离子和氢氧根离子反应生成水,钠离子不反应,则c(Na+)>c(OH-)、c(H+)<c(CH3COO-),故A错误;
B.任何电解质溶液都存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(OH-)+c(CH3COO-),故B正确;
C.常温下,pH<7,说明溶液呈酸性,则c(OH-)<c(H+),若醋酸远远过量,则可以满足:c(CH3COO-)>c(H+)>c(Na+)>c(OH-),故C正确;
D.常温下pH=7,说明溶液呈中性,则c(OH-)=c(H+),根据电荷守恒可知:c(CH3COO-)=c(Na+),故D正确;
故选A.
点评 本题考查了酸碱混合的定性判断、离子浓度定性比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒在判断离子浓度大小中应用方法.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:解答题
| 粒子符号 | 相对分子(原子)质量 | 每个粒子的质量(g/个) | 1mol物质含有的粒子数(个) | 1mol物质质量(g) |
| C | 1.993×10-23 | |||
| Fe | 9.302×10-23 | |||
| H2SO4 | 1.628×10-22 | |||
| H2O | 2.990×10-23 | |||
| Na+ | 3.821×10-23 | |||
| OH- | 2.824×10-23 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al3+ H+ HCO3- | B. | Na+ NO3- Cl- | C. | H+ OH- SO42- | D. | Ca2+ K+ CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
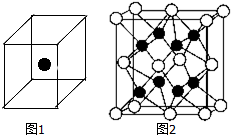 (1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(1)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+HCl | B. | Ag NO3+NaCl | C. | Fe+CuSO4 | D. | NaOH+H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
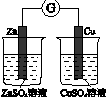 | 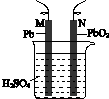 | 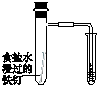 | 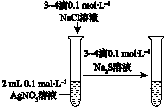 |
| 验证化学能 转化为电能 | 验证铅蓄电池 放电时Pb为负极 | 验证铁 发生析氢腐蚀 | 验证AgCl 溶解度小于Ag2S |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com