
【题目】698K时,向VL的密闭容器中充入2molH2(g)和2molI2(g),发生反应:H2(g)+I2(g)![]() 2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
2HI(g) ΔH=-26.5kJ·mol-1,测得各物质的物质的量浓度与时间变化的关系如图所示。
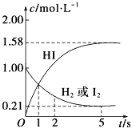
请回答下列问题:
(1)V=______。
(2)该反应达到最大限度的时间是_______,该时间内平均反应速率v(HI)=________。
(3)下列说法中可以说明反应2HI(g)![]() H2(g)+I2(g)已达到平衡状态的是_____。
H2(g)+I2(g)已达到平衡状态的是_____。
A.单位时间内生成nmolH2的同时生成2nmolHI
B.温度和体积一定时,容器内压强不再变化
C.条件一定,混合气体的平均相对分子质量不再变化
D.温度和压强一定时,混合气体的密度不再变化
(4)该反应达到平衡状态时,__________(填“吸收”或“放出”)的热量为______。
【答案】 2 5s 0.316mol·L-1·s-1 A 放出 41.87 kJ
【解析】
(1)根据图象知,氢气和碘初始物质的量浓度为1mol/L,所以容器的体积为2mol÷1mol/L=2L;
(2)当反应达到平衡状态时,各物质的浓度不变,根据图象知,当反应物和生成物浓度不变时,时间为5s;该时间内HI浓度增加了1.58mol/L,则平均反应速率v(HI)=△c÷△t=1.58mol/L÷5s=0.316mol·L-1·s-1;
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。则
A.单位时间内生成nmolH2的同时生成2nmolHI说明正逆反应速率相等,达到平衡状态,A正确;
B.反应前后体积不变,温度和体积一定时,容器内压强始终不变,不能说明反应达到平衡状态,B错误;
C.反应前后气体质量和气体物质的量均不变,混合气体的平均分子量始终不发生变化,不能说明反应达到平衡状态,C错误;
D.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,温度和压强一定时,混合气体的密度不再变化不能说明反应达到平衡状态,D错误。
答案选A。
(4)该反应的正反应是放热反应,所以当反应达到平衡状态时会放出热量,根据碘化氢和反应热之间的关系式可知放出的热量为1.58mol/L×2L×26.5kJ/mol/2=41.87 kJ。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W是原子序数由小到大排列的五种短周期主族元素,其中X、Z、M、W四种元素的原子序数之和为32,在元素周期表中X是原子半径最小的元素,Y原子的最外层电子数是其电子层数的2倍,Z、M左右相邻,M、W位于同主族。回答下列问题:
(1)Y在周期表中的位置是________, W的阴离子符号是_____。
(2)Z的单质的结构式为________。标准状况下,试管中收集满Z的简单氢化物后倒立于水中(假设溶质不向试管外扩散),一段时间后,试管内溶液中溶质的物质的量浓度为_______。
(3)由X、Z、M三种元素组成的化合物是酸、碱、盐的化学式分别为_________、______________、_____________ (各举一例)。
(4)写出加热时Y的单质与W的最高价氧化物的水化物的浓溶液发生反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积固定的密闭容器中,可逆反应:2NO2(g)![]() 2NO(g)+O2(g)达到平衡状态的标志是( )
2NO(g)+O2(g)达到平衡状态的标志是( )
①单位时间内生成nmolO2的同时生成2nmolNO2②单位时间内生成nmolO2的同时生成2nmolNO③用NO2、NO、O2表示的反应速率之比为2∶2∶1④混合气体的颜色不再改变⑤混合气体的密度不再改变⑥混合气体的压强不再改变
A. ①④⑥ B. ②③⑤ C. ①③④ D. 全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有下列离子Na+ 、Fe3+.、Cl-、Fe2+.、NH4+向其中先加入足量的Na2O2,然后微热并搅拌,再加入足量的稀硫酸原溶液中离子数目基本不变的为( )
A.Na+B.Fe3+C.Cl-D.Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
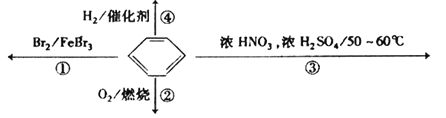
A. 反应![]() 为取代反应,有机产物的密度比水小
为取代反应,有机产物的密度比水小
B. 反应![]() 为取代反应,有机产物是一种烃
为取代反应,有机产物是一种烃
C. 反应![]() 中1mol苯最多与
中1mol苯最多与![]() 发生加成反应,是因为苯分子含有三个碳碳双键
发生加成反应,是因为苯分子含有三个碳碳双键
D. 反应![]() 为氧化反应,反应现象是火焰明亮并带有较多的黑烟
为氧化反应,反应现象是火焰明亮并带有较多的黑烟
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E、F原子序数依次递增。已知:A、B、D、C的价电子数依次增多,A、B、C同周期且C是该周期中电负性最大的元素;A有两个单电子,E的未成对电子数是前四周期中最多的,且其价电子数与D相同, F的最外层电子数为2,内层全部排满。请用对应的元素符号回答下面的问题:
(1)写出E的价电子排布式:______________。
(2)在A形成的化合物中,A采取sp2杂化,且分子量最小的化合物为(写化学式)______________。
(3)下列物质的性质与氢键有关的是______________。
A. 可燃冰的形成 B. A的氢化物的沸点 C. B的氢化物的热稳定性
(4)E3+可以与AB—形成配离子,其中E3+以d2sp3方式杂化,杂化轨道全部用来与AB—形成配位键,则E3+的配位数为______________,1mol该配离子中含有______________molσ键。
(5)F与D形成的化合物晶胞如图,F的配位数为______________,晶体密度为a g/cm3,NA为阿伏加德罗常数,则晶胞边长为______________pm。(1pm=10-10cm)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为H+(aq)+OH(aq)![]() H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是
H2O(l) ΔH=57.3 kJ/mol。稀醋酸、浓硫酸、稀硝酸分别与0.1 mol·L1的NaOH溶液恰好完全反应,放出的热量与消耗NaOH溶液的体积之间的关系如图所示(CH3COOH电离要吸热)。则下列描述正确的是

A.A表示稀硝酸与NaOH溶液的反应
B.B表示稀醋酸与NaOH溶液的反应
C.b=5.73
D.C表示浓硫酸与NaOH溶液的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 mol/L,不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )
A. 0.02 mol/(Lmin)B. 1.2 mol/(Lmin)
C. 1.8mol/(Lmin)D. 0.18 mol/(Lmin)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com