
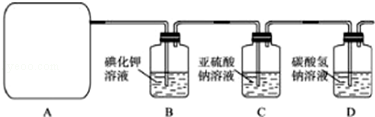

分析 Ⅰ.二氧化锰和浓盐酸反应制取氯气、氯化锰和水;
Ⅱ.(1)根据所给Cl2的生成反应的反应物状态和反应是否需要加热选择气体发生装置;
(2)Na2SO3氧化的产物为Na2SO4,确定存在SO42-即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO32-的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化;
(3)进入D的Cl2与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO3-=CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应;
(4)NaHCO3吸收Cl2的能力有限,应将尾气通入NaOH溶液中;
(5)依据关系式Ca(ClO)2~2Cl2~2I2~4Na2S2O3,计算次氯酸钙的质量进而计算次氯酸钙的质量分数.
解答 解:Ⅰ.二氧化锰和浓盐酸反应制取氯气、氯化锰和水,反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
Ⅱ.(1)依据方程式MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O可知,反应物质为液体与固体,反应条件为加热,应选属于“固+液$\frac{\underline{\;\;△\;\;}}{\;}$气”型的b;
故答案为:b;
(2)Na2SO3氧化的产物为Na2SO4,确定存在SO42-即可证明Na2SO3已部分被氧化.检验时,应取C中溶液少许于洁净试管中,先加稀HCl至不再产生气体以排除SO32-的干扰,然后再加入BaCl2溶液,若产生白色沉淀,则证明Na2SO3已部分被氧化;
故答案为:取少量溶液置于洁净的试管中,向其中滴加稀盐酸至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,证明亚硫酸钠被氧化;
(3)进入D的Cl2与水反应的离子方程式为Cl2+H2O?H++Cl-+HClO,HCl能与NaHCO3反应,离子方程式为H++HCO3-=CO2↑+H2O,HClO因酸性比H2CO3弱而不能与NaHCO3反应;
故答案为:Cl2+H2O?H++Cl-+HClO;H++HCO3-=CO2↑+H2O;
(4)NaHCO3吸收Cl2的能力有限,应将尾气通入NaOH溶液中;
故答案为:应将尾气通入NaOH溶液中;
(5)依据题干给出方程式可得:Ca(ClO)2~2Cl2~2I2~4Na2S2O3,n[Ca(ClO)2]=$\frac{1}{4}$n(Na2S2O3)=20.0 mL×10-3 L•mL-1×0.1 mol•L-1×$\frac{250mL}{25mL}$×$\frac{1}{4}$=0.005 mol,Ca(ClO)2%=$\frac{0.005mol×143g/mol}{2.0g}$×100%=35.75%;
故答案为:35.75%;
点评 本题考查了氯气的实验室制备方法和性质的检验、有关方程式的计算,明确制备原理及性质是解题关键,题(5)注意把握各物质之间量的关系,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 硫酸铜溶于水呈酸性,可用来做杀菌剂 | |
| B. | 氨气具有还原性,可用于检查HCl泄漏 | |
| C. | MgO、Al2O3熔点高,可用于制作耐高温坩埚 | |
| D. | FeCl3溶液显酸性,可用于蚀刻印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L 0.5mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol 对苯二甲酸中含有双键的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收少量二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-═NH3↑+H2O | |
| C. | 过量的铁粉与浓硝酸反应:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O | |
| D. | 向漂白粉溶液中通入适量SO2:Ca2++2C1O-+SO2+H2O═CaSO3↓+2HC1O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | |
| B. | 含大量Al3+的溶液中:K+、Na+、NO3-、HCO3- | |
| C. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=10-12的溶液中:CO32-、Cl-、F-、K+ | |
| D. | 由水电离出的c(OH-)=1×10-13 mol•L-1的无色溶液中:NO3-、Ba2+、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 第一次 | 第二次 | 第三次 | |
| 体积(mL) | 16.10mL | 16.60mL | 15.90mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com