
 �״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO��g��+2H2��g��?CH3OH��g����H
�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ������ҵ��һ��������з�Ӧ�ϳɼ״�CO��g��+2H2��g��?CH3OH��g����H| �¶� | 250�� | 300�� | 350�� |
| K | 3.041 | 1.000 | 0.120 |
���� ��1��ͼ����ƽ�ⳣ�����¶ȱ仯�����жϣ�����ƽ�������ȷ�Ӧ������У�ƽ�ⳣ��K=$\frac{������ƽ��Ũ���ݴη��˻�}{��Ӧ��ƽ��Ũ���ݴη��˻�}$��
��2��300��ʱ�������Ϊ2.0L���ܱ�������ͨ��2mol CO��4mol H2������20s �ﵽƽ��״̬����ϻ�ѧƽ�����м�����ʽ���㣬��Ӧ����v=$\frac{��c}{��t}$������ƽ���������ʵ����ͼ״����ʵ����������������
��300��ʱ�������Ϊ2.0L���ܱ�������ͨ��2mol CO��4mol H2������20s �ﵽƽ��״̬����ϻ�ѧƽ�����м�����ʽ���㣬300��ʱƽ�ⳣ��=1����CO����Ũ��x��
CO��g��+2H2��g��?CH3OH��g��
��ʼ����mol/L�� 1 2 0
�仯����mol/L�� x 2x x
ƽ������mol/L��1-x 2-2x x
�ݴ˼���CO�ķ�Ӧ���ʣ������м״������������
�ڼ����ʱŨ���̺�ƽ�ⳣ���ȽϷ����жϷ�Ӧ���еķ���
��3�������Ȼ�ѧ����ʽ��˹���ɼ���õ���С�Ȼ�ѧ����ʽ��
��4���״�ȼ�ϵ���У������ϼ״�ʧȥ���ӷ���������Ӧ�������������õ��ӷ�����ԭ��Ӧ�����KI��Һ�Ƶ⣬�ڴ��Թ��м��뱥�͵�KI��Һ��Ȼ���ټ��뱽������һ��ʯī�缫��һ�����缫��ʹ�ø�ȼ�ϵ������Դ�����缫���Դ����������ͨ��һ��ʱ��Ͽ���Դ�����Թܣ��ⵥ�����ڱ����ϲ���ҺΪ�Ϻ�ɫ������1.27g �ⵥ������ʱ����Ҫ�״������������ݵ缫��Ӧ�еĵ����غ����õ���
��� �⣺��1�����¶�����ƽ�ⳣ����С������ƽ��������У�����ӦΪ���ȷ�Ӧ����H��0��CO��g��+2H2��g��?CH3OH��g����K=$\frac{c��C{H}_{3}OH��}{c��CO��{c}^{2}��{H}_{2}��}$��
�ʴ�Ϊ������$\frac{c��C{H}_{3}OH��}{c��CO��{c}^{2}��{H}_{2}��}$��
��2����300��ʱ�������Ϊ2.0L���ܱ�������ͨ��2mol CO��4mol H2������20s �ﵽƽ��״̬����ϻ�ѧƽ�����м�����ʽ���㣬300��ʱƽ�ⳣ��=1����CO����Ũ��x��
CO��g��+2H2��g��?CH3OH��g��
��ʼ����mol/L�� 1 2 0
�仯����mol/L�� x 2x x
ƽ������mol/L��1-x 2-2x x
$\frac{x}{��1-x����2-2x��^{2}}$=1
x=0.5mol/L��
20s��CO�ķ�Ӧ����=$\frac{0.5mol/L}{20s}$=0.025mol/��L•s����
��ʱ�����м״����������=$\frac{0.5}{3-2��0.5}$��100%=25%��
����������ƽ����ϵ��ͬʱ����1mol CO��2mol H2��1mol CH3OH���壬��ʱŨ��c��CO��=0.5mol/L+$\frac{1}{2}$mol/L=1mol/L��n��H2��=2��1-0.5��mol/L+$\frac{2mol}{2L}$=2mol/L��c��CH3OH��=0.5mol/L+$\frac{1mol}{2L}$=1mol/L��
�����ʱŨ���Ϻ�Qc=$\frac{1}{1��{2}^{2}}$=0.25��K=1����Ӧ������У�ƽ���ƶ���������ң�
�ʴ�Ϊ��0.025mol/��L•s����25%�����ң���������ƽ����ϵ��ͬʱ����1mol CO��2mol H2��1mol CH3OH���壬��ʱŨ��c��CO��=0.5mol/L+$\frac{1}{2}$mol/L=1mol/L��n��H2��=2��1-0.5��mol/L+$\frac{2mol}{2L}$=2mol/L��c��CH3OH��=0.5mol/L+$\frac{1mol}{2L}$=1mol/L�������ʱŨ���Ϻ�Qc=$\frac{1}{1��{2}^{2}}$=0.25��K=1��ƽ�������ƶ���
��3����2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H1=-1277.0kJ/mol
��2CO��g��+O2��g��=2CO2��g����H2=-566.0kJ/mol
��H2O��g��=H2O��l����H3=-44kJ/mol��
��˹���ɼ���õ�������������-��+4���ۣ���$\frac{1}{2}$д���״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-443.5KJ/mol��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-443.5KJ/mol��
��4���״�ȼ�ϼ��Ե���У��״��ڸ����Ϸ���������Ӧ���״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪCH3OH+8OH--6e-=CO32-+6H2O�����KI��Һ�Ƶ⣬�ڴ��Թ��м��뱥�͵�KI��Һ��Ȼ���ټ��뱽������һ��ʯī�缫��һ�����缫��ʹ�ø�ȼ�ϵ������Դ�����缫���Դ����������ͨ��һ��ʱ��Ͽ���Դ�����Թܣ��ⵥ�����ڱ����ϲ���ҺΪ�Ϻ�ɫ������1.27g �ⵥ������ʱ��n��I2��=$\frac{1.27g}{254g/mol}$=0.005mol�������غ㣺2I--2e-=I2��CH3OH+8OH--6e-=CO32-+6H2O��CH3OH��6e-��3I2��
�״����ʵ���=$\frac{0.005}{3}$mol������=$\frac{0.005}{3}$mol��32g/mol=0.053g��
�ʴ�Ϊ��CH3OH+8OH--6e-=CO32-+6H2O�������Ϻ죻0.053g��
���� ���⿼���˻�ѧ��Ӧ���ʡ���ѧƽ���Ӱ�����ء���Ӧ���ʼ��㡢ƽ�ⳣ�����㡢�Ȼ�ѧ����ʽ��д��ԭ��ص缫��Ӧ��֪ʶ�㣬���ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ��ҵ����ϵ�д�
��ҵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 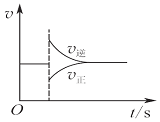 ͼ���Ա�ʾ��ij��ѧƽ����ϵ�ı��¶Ⱥ�Ӧ������ʱ��ı仯 | |
| B�� | 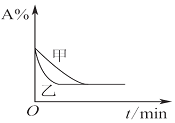 ͼ��ʾѹǿ�Կ��淴Ӧ2A��g��+2B��g��?3C��g��+D��g����Ӱ�죬�Ҽ�ѹǿ�� | |
| C�� | 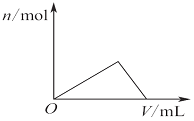 ͼ��ʾ��Al2��SO4��3��MgSO4�Ļ��Һ�еμ�NaOH��Һ�����ɳ������������NaOH��Һ����Ĺ�ϵ | |
| D�� | 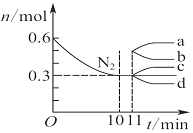 ͼ��ʾ��2 L���ܱ������з����ϳɰ���ӦʱN2�����ʵ�����ʱ��ı仯���ߣ�0��10 min�ڸ÷�Ӧ��ƽ������v��H2��=0.045 mol•L-1•min-1����11 min�������������䣬ѹ�����������Ϊ1 L����n��N2���ı仯����Ϊd |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ڵĵ���ƽ��Ϊ��HCO3-+H2O?H2CO3+OH- | |
| B�� | c��Na+��+c��H+��=c��HCO3-��+c��CO32-��+c��OH-�� | |
| C�� | c��Na+��=c��HCO3-��+c��CO32-��+c��H2CO3�� | |
| D�� | HCO3-�ĵ���̶ȴ���HCO3-��ˮ��̶� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ca2+ CO32- Cl- | B�� | H+ SO42- Ba2+ | ||
| C�� | K+ H+OH- | D�� | Fe3+ Na+ NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����þ��ϡ�����ϣ�O2-+2 H+�TH2O | |
| B�� | ̼������Һ��ʯ���鷴Ӧ��CO32-+Ca2+�TCaCO3�� | |
| C�� | ϡ������п��Ӧ��2 H++Zn�TZn2++H2�� | |
| D�� | ���ˮ�еμ�FeCl3��Һ�Ʊ�Fe��OH��3���壺Fe3++3H2O$\frac{\underline{\;\;��\;\;}}{\;}$Fe��OH��3��+3H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
| �¶�/�� | 400 | 500 | 830 | 1 000 |
| ƽ�ⳣ��K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n��CO2��/mol | 3 | 2.4 | 3.2 | 1 |
| n��H2��/mol | 2 | 1.5 | 2.5 | 1 |
| n��CO��/mol | 1 | 2 | 3.5 | 0.5 |
| n��H2O��/mol | 5 | 2 | 2 | 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͭ��Ʒ�ڳ�ʪ���������⣬����Ҫԭ���Ƿ��������ⸯʴ | |
| B�� | ͭ�ĵ�⾫����ҵ�У������ڵ��۵ײ������������Ϊ���������ȹ��ؽ�����ԭ�� | |
| C�� | ��ĭ���������װ�Լ�ΪNa2CO3��Al2��SO4��3 | |
| D�� | �Ӻ�ˮ�п�����ȡNaCl����ⱥ��NaCl��Һ�����ƽ���Na |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.01 | B�� | 100 | C�� | 0.1 | D�� | ��ȷ�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com