
分析 尾气中的SO2用氨吸收,先用氨水吸收尾气中的SO2,反应生成亚硫酸铵或亚硫酸氢铵,亚硫酸铵或亚硫酸氢铵与硫酸反应生成硫酸铵、二氧化硫和水;
解答 解:尾气中的SO2用氨吸收,先用氨水吸收尾气中的SO2,化学方程式为:SO2+2NH3+H2O=(NH4)2SO3,(NH4)2SO3+SO2+H2O=2NH4HSO3;当吸收液中NH4HSO3达到一定浓度后,再与硫酸反应,放出的SO2可循环利用,生成的(NH4)2SO4可作化肥,化学方程式是:2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O,(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
答:相关化学方程式为SO2+2NH3+H2O=(NH4)2SO3,(NH4)2SO3+SO2+H2O=2NH4HSO3;2NH4HSO3+H2SO4=(NH4)2SO4+2SO2↑+2H2O,(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
点评 本题考查了化学方程式书写方法,注意吸收反应产物的分析判断,掌握基础是关键,题目较简单.


科目:高中化学 来源: 题型:多选题
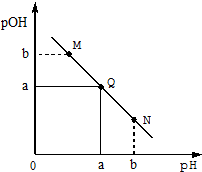 某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列
某温度下,向一定体积0.1mol/LHCl溶液中逐滴加入等浓度的氨水溶液,溶液中pOH[pOH=-lgc(OH-)]与pH的变化关系如右图所示,则下列| A. | Q点消耗氨水溶液的体积等于HCl溶液的体积 | |
| B. | M点所示溶液导电能力弱于Q点 | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | N点所示溶液中c(NH4+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重金属离子Ag+、Cu2+、K+均可导致蛋白质变性 | |
| B. | S02和NxOy都属于非金属氧化物,也都是酸性氧化物 | |
| C. | 部分颗粒分散在空气中可能会形成丁达尔现象 | |
| D. | 苯和苯的衍生物都是芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三角锥形、sp3 | B. | V形、sp2 | C. | 平面三角形、sp2 | D. | 三角锥形、sp2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4.回答下列问题:
某同学设计了如图所示的套管实验装置(部分装置未画出)来制备SO2并利用实验现象来检验其还原性,制备SO2时选用的试剂为Cu和浓H2SO4.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2mol•L-1的盐酸进行滴定,完成下列问题:
实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2mol•L-1的盐酸进行滴定,完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,该反应的类型为酯化反应.
,该反应的类型为酯化反应.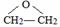 .
.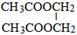 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com