
| A. | 46gNO2和 N2O4混合气体中含有原子总数为3NA | |
| B. | 标准状况下22.4LH2中含中子数为2NA | |
| C. | 7.1k氯气与足量NaOH溶液反应转移的电子数为0.2NA. | |
| D. | 1molC10H22分子中共价键总数为62 NA |
分析 A.NO2和N2O4的最简式为NO2,根据最简式计算出混合物中含有的原子总数;
B.氢气分子中不含中子;
C.氯气与氢氧化钠溶液的反应中,氯气既是氧化剂也是还原剂,0.1mol氯气完全反应转移0.1mol电子;
D.C10H22分子含有共价键为9+22=31.
解答 解:A.46gNO2和N2O4的混合物中含有1mol最简式NO2,含有1mol氮原子、2mol氧原子,总共含有3mol原子,含有原子总数为3NA,故A正确;
B.氢气分子中不含中子,故B错误;
C.7.1g氯气的物质的量为0.1mol,0.1mol氯气与足量氢氧化钠溶液反应转移了0.1mol电子,转移的电子数为0.1NA,故C错误;
D.C10H22分子含有共价键为9+22=31,故1molC10H22分子中共价键总数为31NA,故D错误;
故选A.
点评 本题考查阿伏加德罗常数的有关计算,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:选择题
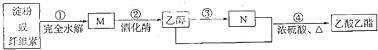
| A. | M的分子式为C12H22O11 | B. | 淀粉与纤维素互为同分异构体 | ||
| C. | ④的反应类型属于取代反应 | D. | N的结构简式为C2H4O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COOH+NaOH═CH3COONa+H2O | B. | HNO3+KOH═KNO3+H2O | ||
| C. | 3HCl+Fe(OH)3═FeCl3+3H2O | D. | 2HCl+Cu(OH)2═CuCl2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1L辛烷完全燃烧所生成的气态产物的分子数为$\frac{8{N}_{A}}{22.4}$ | |
| B. | 1 mol羟基(-OH)所含的电子总数为7NA | |
| C. | 0.5mol 丙烯醛(CH2=CH-CHO)与足量银氨溶液反应,转移的电子数为2NA | |
| D. | 1 mol碳正离子(CH+3)所含的电子总数为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①⑤ | C. | ④⑥ | D. | ③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ①②③ | C. | ①③ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4是硫酸盐 | B. | NaHSO4是酸式盐 | C. | NaHSO4是钠盐 | D. | NaHSO4是酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
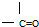 ②
②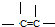 ③
③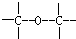 ④
④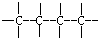
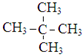
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 烯类化合物 | 相对速率 |
| (CH3)2C=CHCH3 | 10.4 |
| CH3CH=CH2 | 2.03 |
| CH2=CH2 | 1.00 |
| CH2=CHBr | 0.04 |
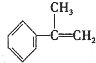 与HBr反应的主要产物的结构简式
与HBr反应的主要产物的结构简式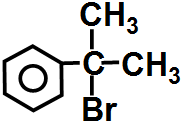 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com