
【题目】下列反应的离子方程式书写正确的是
A. 碳酸钙与足量浓硝酸反应:CaCO3+2H+![]() Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
B. 氢氧化钠溶液与稀醋酸反应:OH-+H+![]() H2O
H2O
C. 氯化铝溶液与过量氨水反应: A13++3OH-=A1(OH)3↓
D. 钠与水反应:Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到100 mL某浓度HNO3中,两者恰好反应,假设反应的还原产物只有NO气体。反应后向所得溶液中加入物质的量浓度为3 mol/L的NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g;则下列有关叙述中不正确的是( )
A.开始加入合金的总物质的量为0.15 mol
B.生成NO气体体积在标准状况下为2.24 L
C.生成沉淀完全时消耗NaOH溶液体积为100 mL
D.参加反应的硝酸的物质的量浓度为1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2 和熔融 KNO3 可作燃料电池,其原理如图所示。该电池在放电过程中石墨Ⅰ电极上生成氧化物 Y,Y 可循环使用。下列说法正确的是
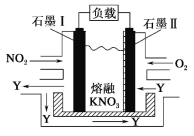
A.放电时,NO![]() 向石墨Ⅱ电极迁移
向石墨Ⅱ电极迁移
B.电池总反应式为 4NO2+O2===2N2O5
C.石墨Ⅱ附近发生的反应为 NO+O2+e- ===NO![]()
D.当外电路通过 4 mol e-,负极上共产生 2 mol N2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.澄清透明的酸性溶液中:Fe3+、Cu2+、SCN-、SO42-
B.能使酚酞变红的溶液中:K+、NH4+、Cl-、NO3-
C.![]() =10-12mol·L-1的溶液中Na+、Al3+、Cl-、SO42-
=10-12mol·L-1的溶液中Na+、Al3+、Cl-、SO42-
D.c(HCO3-)=0.1mol·L-1的溶液中:H+、Mg2+、SO42-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下气体反应达到化学平衡,平衡常数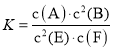 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
A.恒容时,向容器中充入稀有气体,反应速率不变
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s)A(g)+2B(g)
D.正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下对于溶液中一些成分的鉴定,正确的是
A.取少量待测液于试管中,滴加少量的NaOH溶液,若出现白色絮状,则说明待测液中含有![]()
B.取少量待测液于试管中,滴加少量的KSCN溶液,若出现血红色,则说明待测液中不含Fe元素
C.取少量待测液于试管中,滴加少量的![]() 溶液,若出现白色絮状,则说明待测液中含有
溶液,若出现白色絮状,则说明待测液中含有![]()
D.取少量待测液于试管中,滴加少量的NaOH溶液,若出现气泡,则说明待测液中含有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门。下列说法不正确的是
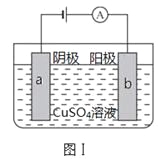
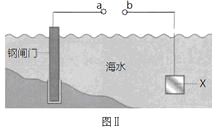
A.图Ⅰ中a为纯铜
B.图Ⅰ中SO42—向b极移动
C.图Ⅱ中如果a、b间连接电源,则a连接负极
D.图Ⅱ中如果a、b间用导线连接,则X可以是铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能___B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为_________________(用元素符号表示)。
(2)D元素原子的价电子排布式是______________。
(3)C元素的电子排布图为________________________;E3+的离子符号为________。
(4)F元素位于元素周期表的____区,其基态原子的电子排布式为______________。
(5)G元素可能的性质______。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com