
用下列装置可测定SO2转化为SO3的转化率。

(1)根据实验的需要,(Ⅰ)(Ⅱ)(Ⅲ)处应连接合适的装置。请从下面装置中选择合适的装置,将其序号填入以下空格内:(Ⅰ) ;(Ⅱ) ;(Ⅲ) 。
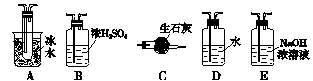
(2)实验时,浓硫酸能顺利地滴入烧瓶中,甲仪器所起作用的原理是 。
(3)用大火加热烧瓶时,SO2的转化率会 (填“提高”“不变”或“降低”)。
(4)用a mol Na2SO3粉末与足量的浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ装置增重b g,则本实验中SO2的转化率为。
(1)B A E
(2)维持烧瓶与分液漏斗液面压强相等,以便打开分液漏斗的旋塞时浓硫酸能顺利流下
(3)降低(4)(1-b/64a)×100%
(1)测定SO2转化为SO3的转化率需要SO2开始时的物质的量和消耗的SO2的物质的量两个数据。关键是后者的测量。根据第(4)问提供的实测数据和题给备选仪器的分析,可知将反应后的混合气体中的SO3冷却成固体,再用NaOH溶液吸收未反应的SO2并称量溶液的增重,即可算出消耗的SO2的物质的量。因此,(Ⅱ)处应连接A,(Ⅲ)处应连接E。SO2与SO3反应之前应除去混在原料气中的H2O,则(Ⅰ)处应连接仪器B。 (3)大火加热烧瓶时,生成SO2过快,SO2的转化率降低。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:浙江省温州市十校联合体2011届高三上学期联考化学试题 题型:022
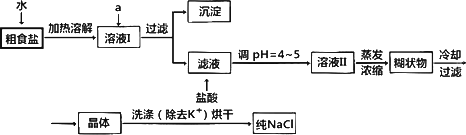
食盐是日常生活的必需品,也是重要的化工原料.
(1)粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO![]() 等杂质离子,实验室提纯NaCl的流程如下:
等杂质离子,实验室提纯NaCl的流程如下:
提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液I中的Ca2+、Mg2+、Fe3+、SO![]() 离子,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
离子,选出a所代表的试剂,按滴加顺序依次为________(只填化学式).
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________.
(2)用提纯的NaCl配制500 mL 4.00 mol·L-1 NaCl溶液,所用仪器除天平、药匙、玻璃棒外还有________(填仪器名称).
(3)电解饱和食盐水的装置如图所示,若收集的H2为2 L,则同样条件下收集的Cl2________(填“>”、“=”或“<”)2 L,原因是________.装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法是________.

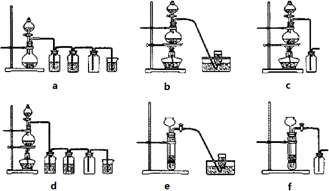
(4)实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4![]() ZnSO4+H2↑;MnO2+4HCl(浓)
ZnSO4+H2↑;MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置________________(填代号)和制备并收集干燥、纯净Cl2的装置________(填代号).
可选用制备气体的装置:
查看答案和解析>>
科目:高中化学 来源:南通中学2007届高三期中考试化学试卷 题型:022
| |||||||||||||||||||||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com