
分析 (1)还需要将晶体研碎的仪器、称量药品的仪器、加热仪器;
(2)冷却药品时需要在干燥器中进行,防止药品吸收空气中水分;
(3)实验步骤⑥是检验结晶水水分完全除去;
(4)A.加热前所用的坩埚未完全干燥,导致加热前后质量减少偏大;
B.实验前被测样品已有部分失水,导致加热前后质量减少偏少;
C.被测样品中含有加热易挥发的杂质,导致加热前后质量减少偏大;
D.被测样品中含有加热不挥发的杂质,导致加热前后质量减少偏少.
解答 解:(1)还需要将晶体研碎的仪器研钵、称量药品的仪器电子天平、加热仪器酒精灯,故答案为:研钵、电子天平、酒精灯;
(2)冷却药品时需要在干燥器中进行,防止药品吸收空气中水分而导致测定值偏小,故答案为:冷却,防止吸水;
(3)反应前后质量减少的质量认为是结晶水的质量,所以实验步骤⑥是检验结晶水水分完全除去,当连续两次称量的质量差不超过0.001g时停止加热,故答案为:检验样品中的结晶水是否已经全部除去;
(4)A.加热前所用的坩埚未完全干燥,导致加热前后质量减少偏大,质量减少量认为是结晶水的质量,所以导致测定值偏高,故错误;
B.实验前被测样品已有部分失水,导致加热前后质量减少偏少,质量减少量认为是结晶水的质量,所以导致测定值偏低,故正确;
C.被测样品中含有加热易挥发的杂质,导致加热前后质量减少偏大,质量减少量认为是结晶水的质量,所以导致测定值偏高,故错误;
D.被测样品中含有加热不挥发的杂质,导致加热前后质量减少偏少,质量减少量认为是结晶水的质量,所以导致测定值偏低,故正确,
故选BD.
点评 本题考查结晶水测定,为高频考点,侧重考查学生实验操作及实验评价能力,明确实验原理及仪器用途是解本题关键,误差分析是易错点,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题
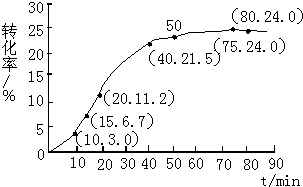 甲酸甲酯水解反应方程式为:
甲酸甲酯水解反应方程式为:| 组分 | HCOOCH3 | H2O | HCOOH | CH3OH |
| 物质的量/mol | 1.00 | 1.99 | 0.01 | 0.52 |
| 反应时间范围/min | 0~5 | 10~15 | 20~25 | 30~35 | 40~45 | 50~55 | 75~80 |
| 平均反应速率/(10-3mol•min-1) | 1.9 | 7.4 | 7.8 | 4.4 | 1.6 | 0.8 | 0.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时的pH | 2.3 | 4.8 |
| 完全沉淀时的pH | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硒是人体必需的微量元素,它在元素周期表中的位置如图所示.
硒是人体必需的微量元素,它在元素周期表中的位置如图所示.| 磷 | 硫 | ||
| 砷 | 硒 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
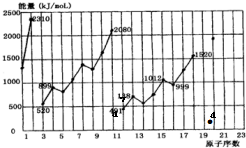
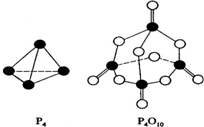 (1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.
(1)CH3-CH3(g)→CH2=CH2(g)+H2(g);有关化学键的键能如下.| 化学键 | C-H | C=C | C-C | H-H |
| 键能(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
| 化学键 | P-P | P-O | P=O | O-O | O=O |
| 键能(kJ/mol) | a | b | c | d | e |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
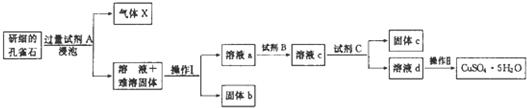
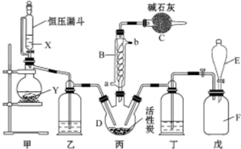 磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.
磺酰氯(SO2Cl2)是一种重要的有机合成试剂,实验室可利用SO2与Cl2反应制取少量的SO2Cl2,装置如图(有些夹持装置省略)所示.已知SO2Cl2的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈的水解反应,并产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
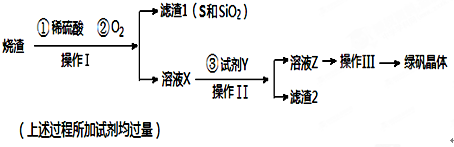
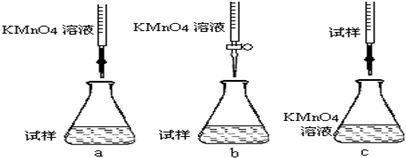
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解 | |
| B. | 滤去不溶性杂质后,将滤液移至坩埚内加热浓缩 | |
| C. | 除去粗盐中的Mg2+应加入过量的KOH,然后过滤 | |
| D. | 粗盐提纯最后一步应向滤液中加入盐酸,调节溶液的值 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com