铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
(1)铬原子核中质子数为24,铬位于周期表中第
四
四
周期
ⅥB
ⅥB
族.
c(OH-)≥10-4mol?L-1
c(OH-)≤10-6mol?L-1
(2)铬元素以Cr
2O
72-离子的形式存在于酸性废水中,常用FeSO
4将其还原为Cr
3+离子,再用沉淀法进行分离.已知:
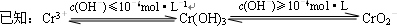
①FeSO
4还原Cr
2O
72-的离子方程式为
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
.
②Cr
2 (SO
4)
3溶液中加入过量NaOH浓溶液,反应的离子方程式为
Cr3++4OH-=CrO2-+2H2O
Cr3++4OH-=CrO2-+2H2O
.
③沉淀法分离废水中的Cr
3+离子,pH应控制在
8~10
8~10
范围内.
④下列关于铬及其化合物的说法中正确的是
ABCD
ABCD
.
A.K
2Cr
2O
7是一种常用的强氧化剂 B.NaCrO
2溶液与AlCl
3溶液混合有沉淀生成
C.酸性K
2Cr
2O
7溶液可用于检验司机是否酒后驾车
D.金属铬硬度大、耐腐蚀,是常用的镀层金属
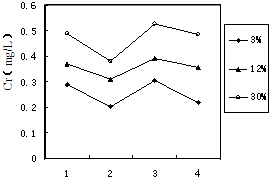
(3)铬冶炼工业的废渣粉碎后掺入煤矸石经过高温处理可以制砖,为了探究其中的铬元素在使用过程中是否会重新污染环境,研究组在一定条件下浸溶砖样,检测浸出液中Cr元素浓度,结果如图:
说明:1--用蒸馏水浸溶,2--用稀硫酸浸溶,3--冻融后用蒸馏水浸溶,4--曝晒后用蒸馏水浸溶;
3%等--制砖时含铬废渣掺入的比例.
已知我国规定“固体废弃物浸出标准值含铬不得超过10mg?L
-1”.分析图表,可得出多个结论:
①实验取用的砖样是否符合上述标准:
符合
符合
.
②还能得出的其它结论是(写出2条即可)
其它条件相同时,含铬废渣掺入的比例越大,Cr元素浸出的浓度越高
其它条件相同时,含铬废渣掺入的比例越大,Cr元素浸出的浓度越高
;
酸性环境对Cr元素浸出有抑制作用;
酸性环境对Cr元素浸出有抑制作用;
.



 铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准.
铬(Cr)属于重金属元素,含铬废水和废渣排放必须经过处理达到有关的安全标准. ①FeSO4还原Cr2O72-的离子方程式为
①FeSO4还原Cr2O72-的离子方程式为
 或
或
 或
或