
下列含有极性键的非极性分子是 (1)CCl4(2)NH3(3)CH4(4)CO2(5)N2
(6)H2S(7)SO2(8)CS2(9)H2O(10)HF
A.(2)(3)(4)(5)(8) B.(1)(3)(4)(5)(8)
C.(1)(3)(4)(8) D.以上均不对
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:阅读理解
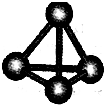 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.



查看答案和解析>>
科目:高中化学 来源:贵州省遵义四中2010-2011学年高二上学期期末考试化学理科试题 题型:013
|
下列分子中,属于含有极性键的非极分子的是 ①CO2 ②P4 ③NH3 ④CH4 ⑤H2O | |
| [ ] | |
A. |
①② |
B. |
①④ |
C. |
④⑤ |
D. |
③⑤ |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年福建省高三下学期第六次模拟考试(理综)化学部分 题型:填空题
【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为 。
(2)熔沸点:NH3 PH3(>、<、=)原因是
(3)N、P、As三种元素电负性由小到大的顺序为 ,NCl3分子中中心原子的杂化方式为 。
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内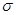 键和
键和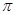 键的比为
。
键的比为
。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有 ,配位体为 。
A.氢键 B.离子键 C.共价键 D.配位键[ E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【化学—物质结构与性质】
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要作用。
请回答下列问题。
(1)砷原子外围电子排布式为 。
(2)熔沸点:NH3 PH3(>、<、=)原因是
(3)N、P、As三种元素电负性由小到大的顺序为 ,NCl3分子中中心原子的杂化方式为 。
(4)汽车尾气中CO和NO经催化剂作用变成N2和CO2,此反应中三种元素第一电离能由小到大的顺序为 ,在这四种物质中含有极性键的非极分子内键和
键的比为 。
(5)K3[Fe(CN)6]配合物中微粒的相互作用力有 ,配位体为 。
A.氢键 B.离子键 C.共价键 D.配位键[ E.范德华力
(6)CO、NH3都能提供孤电子对与Cu+形成配合物。Cu+与NH3形成的配合物可表示为
[Cu(NH3)n]+。该配合物中,Cu+的4s轨道及4p轨道通过sp杂化接受NH3提供的孤电子对,则[Cu(NH3)n]+中n的值为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com