
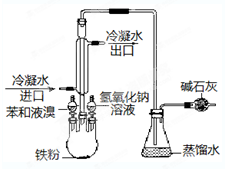
 如图是实验室制取溴苯的装置图:
如图是实验室制取溴苯的装置图: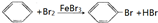 ,
,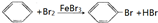 ;
;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、对某溶液进行焰色反应时火焰颜色为黄色,则该溶液中一定有Na+,可能有K+ |
| B、向某溶液中加入AgNO3溶液产生白色沉淀,加入洗盐酸时沉淀不溶解,可确定有Cl-存在 |
| C、加入盐酸时有能使澄清石灰水变浑浊的气体生成,则原溶液中一定有CO32-存在 |
| D、分别含有Mg2+、Cu2+、Fe2+和Na+四种离子的溶液,只用NaOH溶液不可能鉴别成功 |
查看答案和解析>>
科目:高中化学 来源: 题型:
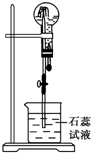 物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的B.按如图所示装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓硫酸反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按如图所示装置仪器,挤压滴管的胶头时,可以得到红色喷泉.
物质A是一种白色晶体,它与浓NaOH溶液共热,放出无色气体B,用圆底烧瓶收集干燥的B.按如图所示装置仪器,挤压滴管的胶头时,可以得到蓝色喷泉;A与浓硫酸反应,放出无色气体C,用圆底烧瓶收集干燥的C,仍按如图所示装置仪器,挤压滴管的胶头时,可以得到红色喷泉.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NaCl固体和浓硫酸各自配制0.5mol.L-1的溶液,所用仪器完全相同 |
| B、酸式滴定管注入NaHCO3溶液之前应进行捡漏、洗涤和润洗 |
| C、过滤、溶解、蒸发操作中都需要使用玻璃棒 |
| D、用小试管和胶头滴管不能鉴别出Na2CO3溶液、稀盐酸、Ba(OH)2溶液、酚酞试液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、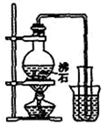 制取少量蒸馏水 |
B、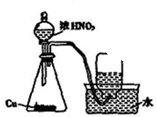 用铜和浓硝酸制取少量NO3 |
C、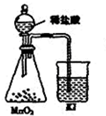 比较MnO2、Cl2、I2的氧化性 |
D、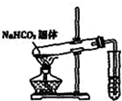 探究NaHCO3的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 过程ⅣB溶液中含有的离子 | 过程ⅥB溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用石灰石或石灰乳进行燃煤烟气脱硫(除SO2)可获得副产品石膏 |
| B、金属的电化学防护措施有牺牲阳极的阴极保护法和外加电流的阴极保护法 |
| C、若在水里贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 |
| D、常温时,某可逆反应的平衡常数越大则其反应速率就越快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该混合溶液汇总一定不含有Fe3+、AlO2-、Al3+、CO32- |
| B、在溶液中滴加酚酞试液后呈红色,加入BaCl2溶液,红色褪去,并产生白色沉淀 |
| C、该混合溶液中肯定含有Fe2+、NH4-、SO42-、NO3- |
| D、通过进行焰色反应可以确定是否含有I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com