
| 实验步骤 | 有关问题 |
| (1)计算并称量 | 需要NaCl的质量为______g |
| (2)溶解 | 为加速溶解,可进行的操作是______ |
(3)转移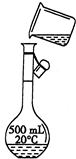 | 指出示意图中的两处错误: 错误1:______ 错误2:______ |
| (4)定容 | 若俯视容量瓶刻度线,定容后会造成所配溶液的物质的量浓度______(填“偏高”“偏低”或“无影响”) |
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.定容摇匀后,有少量溶液外流 |
| B.定容时,俯视液面 |
| C.称量时,在天平托盘上放上称量纸,将NaCl固体放在纸上称量 |
| D.溶解NaCl的烧杯未洗涤 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
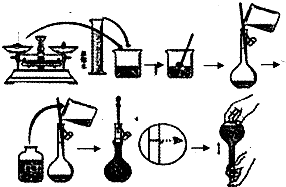
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com