
| A. | HO(CH2)2CHO | B. | HO(CH2)2COOH | C. | HOOC-COOH | D. | CH3COOH |
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | ①、② | B. | ①、④ | C. | ①、③ | D. | ②、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间变化 | |
| B. | 容器内各物质的浓度相等 | |
| C. | 容器内 X、Y、Z 的浓度之比为 1:2:2 | |
| D. | 单位时间消耗 0.1molX 同时生成 0.2molZ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
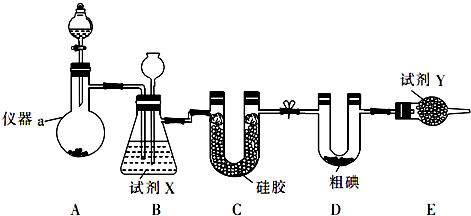
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
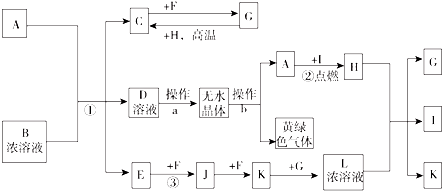
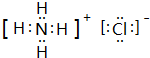 ;I分子的空间构型为直线形.
;I分子的空间构型为直线形.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
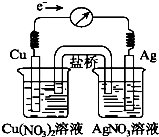 将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )
将反应Cu(s)+2Ag+(aq)?Cu2+(aq)+2Ag(s)设计成原电池,某一时刻的电子流向及电流计(G)指针偏转方向如图所示,有关叙述正确的是( )| A. | KNO3盐桥中的K+移向Cu(NO3)2溶液 | |
| B. | 当电流计指针指向0时,该反应达平衡,平衡常数K=0 | |
| C. | 若向硝酸银溶液中加入NaCl固体,随着NaCl量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 | |
| D. | 向硝酸铜溶液中加入NaOH固体,随着NaOH量的增加,电流计指针向右偏转幅度减小→指针指向0→向左偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇酚酞变红的溶液中:Na+、Cl-、Ba2+、CH3COO- | |
| B. | 常温下Kw/c(H+)=1×10-13mol/L的溶液中:SO42-、Fe2+、ClO-、NH4+ | |
| C. | 水电离出的c(H+)=10-10mol/L的溶液中:Na+、K+、Cl-、HCO3- | |
| D. | 0.5mol/LAlCl3溶液中可能大量存在:Ca2+、AlO2-、K+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2溶于水,其水溶液能导电,说明SO2是电解质 | |
| B. | 向纯水中加入盐酸或金属钠都能使水的电离平衡逆向移动,水的离子积不变 | |
| C. | 向氯水中加入NaHCO3 (固体)可使溶液中c(HClO)增大 | |
| D. | 室温下,将浓度为0.1 mol•L-1 HF溶液加水稀释,其电离平衡常数和 c(H+)/c(HF)均不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com