
【题目】按要求填空
(1)烷烃A在同温、同压下蒸气的密度是![]() 的43倍,其分子式为______。
的43倍,其分子式为______。
(2)![]() 烷烃E完全燃烧,消耗标准状况下的
烷烃E完全燃烧,消耗标准状况下的![]()
![]() ,其分子式为______。
,其分子式为______。
(3)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为______。
(4)某有机物的结构表达式为![]() ,其名称是______。
,其名称是______。
(5)萘的结构式为![]() ,其分子式为______。
,其分子式为______。
(6)立方烷![]() 的六氯代物有______种。
的六氯代物有______种。
【答案】C6H14 C3H8 6 5-甲基-2-庚烯 C10H8 3
【解析】
(1)根据同温、同压下,气体的密度之比等于相对分子质量之比,首先计算A的相对分子质量,再根据烷烃的通式CnH2n+2计算判断;
(2)根据烷烃燃烧的通式分析计算;
(3)烷基的通式为-CnH2n+1,根据式量确定烷基的种类,利用等效H判断甲苯苯环上的H原子种类,据此分析判断;
(4)该有机物主链含有7个C,且含有碳碳双键,根据烯烃的命名规则命名;
(5)根据结构简式分析判断萘的分子式;
(6)根据立方烷的结构分析判断其二氯代物的同分异构体数目,六氯代物与二氯代物的同分异构体数目相同,据此分析判断。
(1)同温、同压下,气体的密度之比等于相对分子质量之比,因此M(A)=43×2=86,设烷烃为CnH2n+2,则12n+2n+2=86,解得n=6,分子式为C6H14,故答案为:C6H14;
(2)0.1 mol烷烃E完全燃烧消耗O2的物质的量为![]() =0.5 mol,所以1molE完全燃烧,消耗
=0.5 mol,所以1molE完全燃烧,消耗![]() =5mol氧气,根据反应CnH2n+2+
=5mol氧气,根据反应CnH2n+2+![]() O2→nCO2+(n+1)H2O,可得:
O2→nCO2+(n+1)H2O,可得:![]() =5,解得:n=3,则E的分子式为C3H8,故答案为:C3H8;
=5,解得:n=3,则E的分子式为C3H8,故答案为:C3H8;
(3)烷基组成通式为-CnH2n+1,烷基式量为43,所以14n+1=43,解得n=3,所以该烷基为-C3H7,可以为正丙基和异丙基。当为正丙基时,甲苯苯环上的H原子种类有3种,所以有3种同分异构体;当为异丙基时,甲苯苯环上的H原子种类有3种,所以也有3种同分异构体,故该芳香烃产物的种类数为6种,故答案为:6;
(4)有机物![]() 主链含有7个C,且含有碳碳双键,为5-甲基-2-庚烯,故答案为:5-甲基-2-庚烯;
主链含有7个C,且含有碳碳双键,为5-甲基-2-庚烯,故答案为:5-甲基-2-庚烯;
(5)![]() 的结构中含10个碳原子,8个H原子,故分子式为C10H8,故答案为:C10H8;
的结构中含10个碳原子,8个H原子,故分子式为C10H8,故答案为:C10H8;
(6)立方烷(![]() )中含8个碳原子,每个碳原子上连一个H原子;立方烷的二氯代物的同分异构体分别是:一条棱、面对角线、体对角线上的两个氢原子被氯原子代替,所以二氯代物的同分异构体有3种;分子中共含有8个H原子,则六氯代物与二氯代物的同分异构体数目相同,六氯代物的同分异构体有3种,故答案为:3。
)中含8个碳原子,每个碳原子上连一个H原子;立方烷的二氯代物的同分异构体分别是:一条棱、面对角线、体对角线上的两个氢原子被氯原子代替,所以二氯代物的同分异构体有3种;分子中共含有8个H原子,则六氯代物与二氯代物的同分异构体数目相同,六氯代物的同分异构体有3种,故答案为:3。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,请回答下列问题:
(1)某贫困山区,为了寻找合适的饮用水,对山上的泉水进行了分析化验,结果显示,水中主要含Ca2+、Mg2+、Cl﹣和SO42﹣。则该硬水属于_____(填“暂时”或“永久”)硬度,若要除去Ca2+、Mg2+,可以往水中加入石灰和纯碱,试剂加入时先加______后加___________。
(2)我国规定饮用水的硬度不能超过25度,硬度的表示方法是:将水中的Ca2+和Mg2+都看作Ca2+,并将其折算成CaO的质量,通常把1升水中含有10mg CaO称为1度,某化学实验小组对本地区地下水的硬度进行检测。
实验中涉及的部分反应:
M2+(金属离子)+EBT﹣(铬黑T)═MEBT+
蓝色 酒红色
M2+(金属离子)+Y4﹣(EDTA)═MY2﹣
MEBT++Y4﹣(EDTA)═MY2﹣+EBT﹣(铬黑T )
实验过程:
①取地下水样品25.00mL进行预处理,写出由Mg2+引起的暂时硬度的水用加热方法处理时所发生反应的化学方程式:_______________。
②预处理的方法是向水样中加入浓盐酸,煮沸几分钟,煮沸的目的是______________。
③将处理后的水样转移到250mL的锥形瓶中,加入氨水﹣氯化铵缓冲溶液调节pH为10,滴加几滴铬黑T溶液,用0.010 00molL﹣1的EDTA标准溶液进行滴定,滴定终点时共消耗EDTA溶液15.00mL,则该地下水的硬度为________________。
(3)某工业废水中含有CN﹣和Cr2O72﹣等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
①流程②中,反应后无气体放出,该反应的离子方程式为______________________。
②含Cr3+废水需进一步处理,请你设计一个处理方案:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) ![]() 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
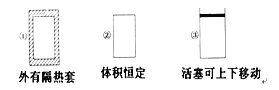
A. ③②①B. ③①②C. ①②③D. ②①③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为![]() 的两个恒容密闭容器中加入足量相同的碳粉,再分别加入
的两个恒容密闭容器中加入足量相同的碳粉,再分别加入![]() 和
和![]() ,在不同温度下反应
,在不同温度下反应![]() 达到平衡,平衡时
达到平衡,平衡时![]() 的物质的量浓度
的物质的量浓度![]() 随温度的变化如图所示
随温度的变化如图所示![]() 图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上
图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()

A.反应![]() 的
的![]()
B.体系的总压强![]() 状态Ⅱ
状态Ⅱ![]() 状态Ⅲ
状态Ⅲ![]()
C.体系中![]() ,状态Ⅱ
,状态Ⅱ![]() ,状态Ⅲ
,状态Ⅲ![]()
D.逆反应速率![]() 状态Ⅰ
状态Ⅰ![]() 状态Ⅲ
状态Ⅲ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 在水中的电离方程式为:
在水中的电离方程式为:![]() 。某温度下,向
。某温度下,向![]() 的蒸馏水中加入
的蒸馏水中加入![]() 晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,正确的是
A.该溶液中![]() 浓度为
浓度为![]()
B.由水电离出来的![]() 的浓度是
的浓度是![]()
C.加入的![]() 的物质的量为
的物质的量为![]()
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.10 mol·L-1标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
实验 序号 | 待测液 体积/mL | 所消耗NaOH标准液的体积/mL | |
滴定前读数/mL | 滴定后读数/mL | ||
1 | 20.00 | 0.50 | 20.54 |
2 | 20.00 | 6.00 | 26.00 |
3 | 20.00 | 1.40 | 21.36 |

(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点____________。
(2)滴定过程中,眼睛应注视_____________________;
(3)盐酸的物质的量浓度为___________。
(4)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是__________(填“偏高”“偏低”或“无影响”)。
(5)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在________(填“甲”或“乙”)中,该反应的离子方程式为_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL1mol/LNH2OH![]() 溶液中加水进行稀释,所得曲线如图所示V表示溶液的体积
溶液中加水进行稀释,所得曲线如图所示V表示溶液的体积![]() ,
,![]() 。下列说法不正确的是
。下列说法不正确的是![]()
![]()

A.![]() 的电离平衡常数Kb的数量级为
的电离平衡常数Kb的数量级为![]()
B.用![]() 的盐酸滴定10ml1mol/LNH2OH溶液至
的盐酸滴定10ml1mol/LNH2OH溶液至![]() ,消耗盐酸体积小于10mL
,消耗盐酸体积小于10mL
C.当溶液稀释至![]() 时,溶液中由水电离出的
时,溶液中由水电离出的![]()
D.![]() 溶液中离子浓度大小关系:
溶液中离子浓度大小关系:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ:现有两个体积相等的恒容密闭容器,向甲容器中加入1molA和1 molB,乙容器中加入1molX和3molY,两容器中分别发生下列两个反应,反应开始时甲、乙两容器的反应条件相同。

回答下列问题:
(1)反应达到平衡时,甲、乙两容器中平均反应速率v(A)与v(X)的大小关系是___。(填序号)。
A.前者大于后者 B.前者小于后者 C.前者等于后者 D.无法比较
(2)甲中反应达到平衡后,若给甲容器升温,正反应速率将___(填“增大”、“减小”或“不变”)。
(3)表示乙中反应达到平衡的标志是___(填序号)。
①X、Y、Z的物质的量之比为1:3:2
②X、Y、Z的浓度不再发生变化
③容器中的温度不再发生变化
④3v正(Y)=2v逆(Z)
Ⅱ:工业上利用CO和水蒸气在一定条件下发生反应制取氢气:CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41kJ·mol1
CO2(g)+H2(g) △H=-41kJ·mol1
某化学兴趣小组同学研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
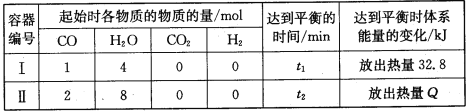
(1)容器Ⅰ中反应达到平衡时,CO的转化率为___。
(2)容器Ⅱ中反应的平衡常数K=___。
(3)下列叙述正确的是___(填字母)。
a.平衡时,两容器中H2 的体积分数相等
b.容器Ⅱ反应达到平衡状态时,Q>65.6
c.反应开始时,两容器中反应的速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于上述高分子生物材料的说法中正确的是( )
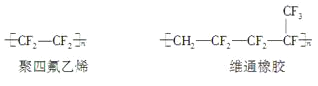
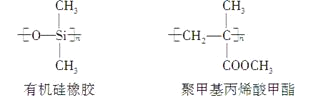
A.用于合成维通橡胶的单体是CH2=CF—CF2—CF2—CF3
B.用于合成有机硅橡胶的单体是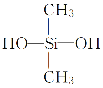
C.聚四氟乙烯、有机硅橡胶均可看作加聚反应的产物
D.有机硅橡胶、聚甲基丙烯酸甲酯均可通过缩聚反应制得
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com