
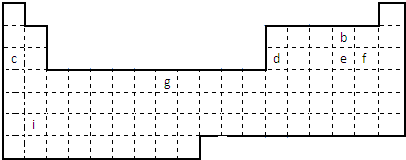
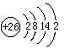 ;
;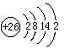 ,则原子次外层电子数为14,故答案为:8;14;
,则原子次外层电子数为14,故答案为:8;14;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
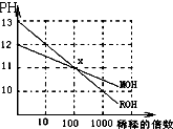
| A、在x点,ROH未完全电离 |
| B、在x点,c(M+)>c(R+) |
| C、稀释前,c(ROH)=10c(MOH) |
| D、pH=2的盐酸与pH=12的MOH等体积混合后,溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
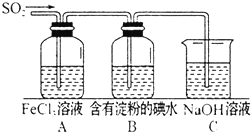 某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸乙酯(乙酸):加饱和Na2CO3溶液,充分振荡静置后,分液 |
| B、乙醇(水):加入新制生石灰,蒸馏 |
| C、溴苯(溴):加入NaOH溶液,充分振荡静置后,分液 |
| D、乙酸(乙醇):加入金属钠,蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
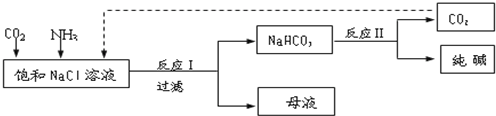
| ||
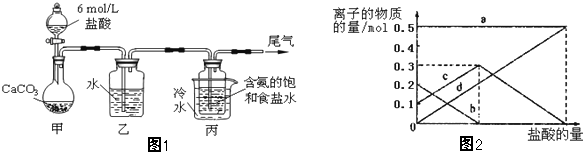
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com