
 (1)已知在一定温度下,各反应的平衡常数如下:
(1)已知在一定温度下,各反应的平衡常数如下:分析 (1)①0.5C(s)+0.5CO2(g)?CO(g),K1
②CO(g)+H2O(g)?H2(g)+CO2(g),K2
③C(s)+H2O(g)?CO(g)+H2(g),K3
结合盖斯定律可知,③-①×2得到②;
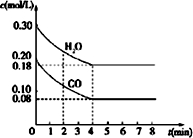
(2)由图可知浓度的变化,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 0.2 0.3 0 0
转化 0.12 0.12 0.12 0.12
平衡 0.08 0.18 0.12 0.12
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%、K为生成物浓度幂之积与反应物浓度幂之积的比计算;
(3)结合Qc与K的关系判断方向,再结合三段法计算.
解答 解:(1)①0.5C(s)+0.5CO2(g)?CO(g),K1
②CO(g)+H2O(g)?H2(g)+CO2(g),K2
③C(s)+H2O(g)?CO(g)+H2(g),K3
结合盖斯定律可知,③-①×2得到②,则K2=$\frac{{K}_{3}}{{{K}^{2}}_{1}}$,
故答案为:$\frac{{K}_{3}}{{{K}^{2}}_{1}}$;
(2)由图可知浓度的变化,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 0.2 0.3 0 0
转化 0.12 0.12 0.12 0.12
平衡 0.08 0.18 0.12 0.12
则0~4 min的平均反应速率ν(CO)=$\frac{0.12mol/L}{4min}$=0.03 mol/(L•min),
CO的转化率为$\frac{0.12}{0.2}$×100%=60%;
此时该反应的平衡常数为K=$\frac{0.12×0.12}{0.08×0.18}$=1,
故答案为:0.03;60%; 1;
(3)850℃时,若起始时加入的CO、H2O、CO2和H2物质的量分别为0.1 mol、0.7 mol、0.3 mol和0.9 mol,
Qc=$\frac{0.3×0.9}{0.1×0.7}$=4.1>K,则平衡逆向移动,v (正)<v(逆),
设转化的氢气为x,则
CO(g)+H2O(g)?CO2(g)+H2(g)
开始 0.1 0.7 0.3 0.9
转化 x x x x
平衡 0.1+x 0.7+x 0.3-x 0.9-x
则$\frac{(0.3-x)(0.9-x)}{(0.1+x)(0.7+x)}$=1,
解得x=0.1,
可知达到平衡时CO的体积分数为$\frac{0.2}{0.2+0.8+0.2+0.8}$×100%=20%,
故答案为:<;20%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K的计算及图象分析为解答的关键,侧重分析与计算能力的考查,注意K只与温度有关及平衡移动方向的判断,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Z的分解速率和生成速率相等 | |
| B. | X、Y、Z的浓度不再变化 | |
| C. | 反应体系的总质量保持不变 | |
| D. | 单位时间内生成2nmolZ,同时生成nmolX |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3和NaOH溶液反应:Al2O3+2OH-═2AlO2-+H2↑ | |
| B. | AlCl3与过量NaOH溶液反应:Al3++3OH-═Al(OH)2↓ | |
| C. | NO2溶于水:3NO2+H2O═2NO3-+2H++NO↑ | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:3 | C. | 1:2 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y的氢化物沸点比M氢化物的沸点低 | |
| B. | X2Y2是离子化合物,MY2是共价化合物 | |
| C. | ZX可做还原剂,与水反应后溶液会显碱性 | |
| D. | 四种元素形成的化合物为强电解质,其水溶液会呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 10min | 20min | 30min | 40min | |
| T1 | 30% | 55% | 65% | 65% |
| T2 | 35% | 50% | a1 | a2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4LN2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.
150℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4LN2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度.平衡后容器体积变为3.4L,容器内气体对相同条件的氢气的相对密度为5.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
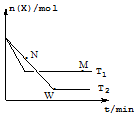 一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )
一定温度下,向某密闭容器中通入X,发生反应:4X(g)?2Y(g)+Z(g)△H,在温度分别为T1、T2 的条件下X的物质的量n(X) 随时间t的变化曲线如图所示.下列有关叙述错误的是( )| A. | △H<0 | |
| B. | 平衡时Z的产率:T2<T1 | |
| C. | M、N、W三点对应的混合气体的平均相对分子质量:W>M>N | |
| D. | M点的正反应速率大于N点的逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
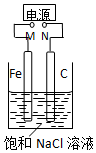
| A. | M接电源正极,N接电源负极,将C电极换成Cu电极,电解质溶液换成CuSO4溶液,则可实现在铁上镀铜 | |
| B. | M接负极,N接正极,在溶液中滴人酚酞试液,C电极周围溶液变红 | |
| C. | M接负极,N接正极,若把烧杯中溶液换成1 L CuSO4溶液,反应一段时间后,烧杯中产生蓝色沉淀 | |
| D. | M接负极,N接正极,当两极产生气体总量为22.4 L(标准状况)时,生成1molNaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com